-
平台介绍
-
EPSA测试方法
-
案例分享
-
常见问答
-
相关资源
-
相关服务
平台介绍
IMHBs结合与膜渗透性增加相关,因此,在药物设计过程中,识别化合物形成IMHBs潜力和隐藏极性,以及改善被动渗透性是重要考虑因素。传统的膜渗透性监测方法如基于细胞模型的药物筛选或PAMPA (parallel artificial membrane permeation assay)对大分子适用性低的问题,而多肽的渗透性主要障碍是极性问题,因此,对于多肽渗透性的评估,EPSA(exposed polar surface area)技术是一种合适的工具。药明康德药物代谢与动力学部采用行业内广泛认可和使用的SFC色谱方法检测化合物的EPSA值。这种方法具有方法灵敏度和准确度高、结果重现性好、对细胞渗透性能做出快速预测,并对现有细胞渗透性检测和预测技术进行有效补充等优点,为业内设计具有良好药代动力学特征化合物提供参考。
了解更多



EPSA测试方法
-
理论浓度
100 μM
流动相
含20 mM 甲酸铵的甲醇/CO2
化合物需求量
20 μL 样品浓度为10 mM的 DMSO储备溶液
分析方法
UPCC-PDA/UPCC-MS/MS
检测周期
5个工作日
案例分享
-
极性是影响分子被动渗透性的重要理化性质。药明康德药性评价部已成功建立利用SFC技术检测EPSA的高通量色谱方法,提供一项识别分子中隐藏的IMHBs和评估其暴露极性,是预测分子渗透性的重要指标之一。
选择8种化合物作为校准标准品。EPSA和保留时间的线性关系如下图1所示。
基于14种商业化合物的EPSA和Bland Altman分析与文献的相关性的验证数据如下图2和图3。
-


图 1
-

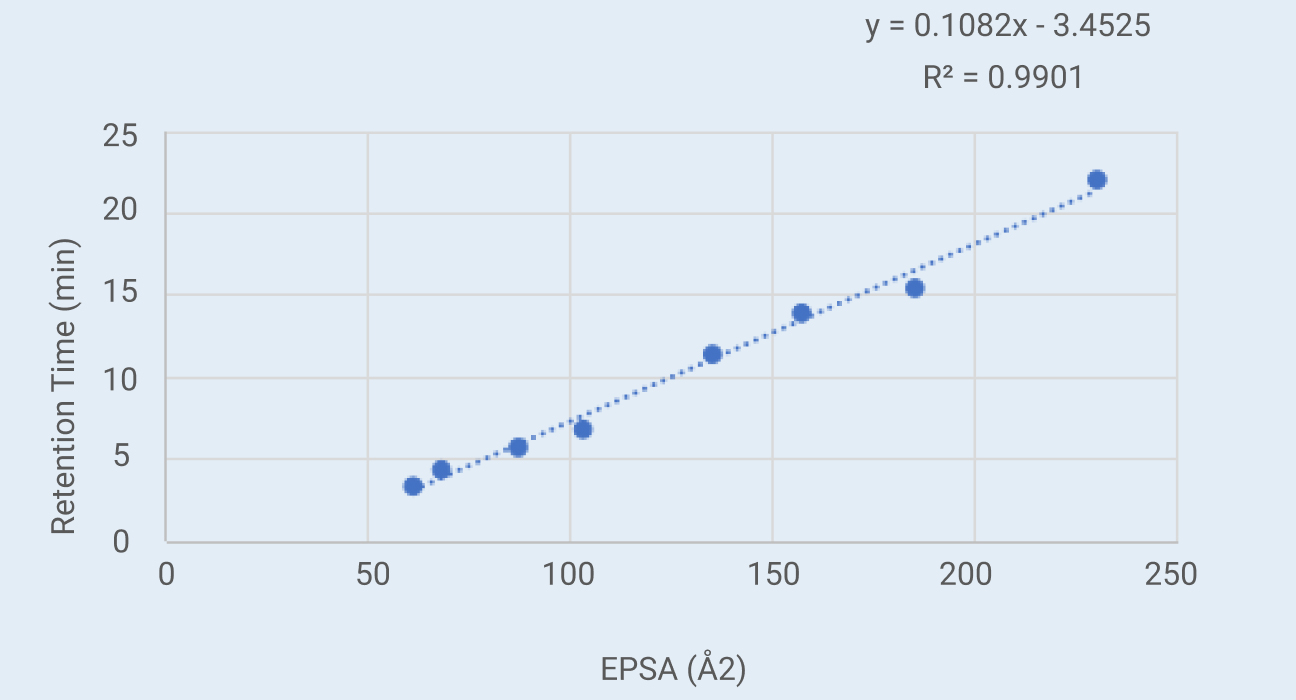
图 2
-

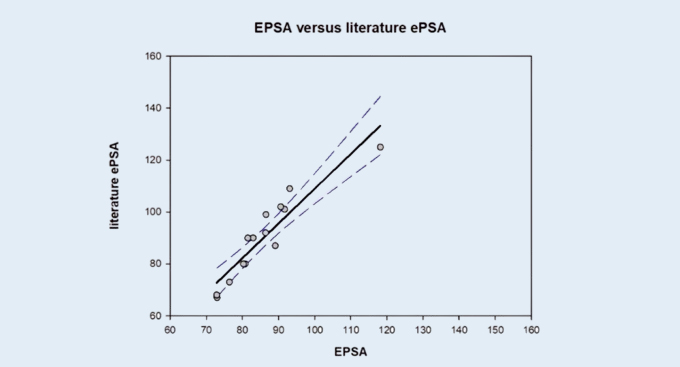
图 3
-
常见问答
-
相比于TPSA(topological polar surface area),EPSA的显著优势是什么?
TPSA是一种理论计算方法,可通过计算机软件分析平台获得极性原子的表面积,从而评估分子极性,结果侧重极性原子的空间分布,不考虑其实际暴露程度;而EPSA是一种实验测量方法,侧重于分析分子表面暴露的极性区域,这些区域可能会与溶剂或其它分子发生相互作用。二者均有助于预测药物分子的溶解度、渗透性和生物利用度。但是,EPSA得益于SFC技术,更能模拟分析物在脂质双分子层的内部疏水中心形成的构象极性和形成氢键潜力,对药物开发早期阶段的渗透性更具有预测性。
-
检测EPSA值,为什么要使用SFC系统?
分析物相对于固相的保留主要由极性驱动,该行为能够通过保留时间分析鉴别配对分子之间的 IMHBs。相比于使用由水和与水混溶的有机溶剂组成的流动相。scCO2作为流动相能避免水破坏目标化合物内的任何IMHBs。此外,基于SFC系统测定EPSA更快,更耐用;即使对于高极性化合物,也可使用改性剂作为流动相成分进行测定。而且,由于SFC系统中的色谱保留测量是在一个各向异性的环境中进行的,这意味着分子之间的相互作用受到分子空间取向和拓扑构象分布的影响。这种各向异性更接近生物膜的特性。因此,使用SFC系统得到的EPSA被认为更能够预测化合物的生物活性或其它特性。
-
如果化合物没有紫外吸收还能准确测定EPSA吗?
支持使用PDA和质谱的方法检测EPSA。当化合物没有紫外吸收时,会使用UPCC-MS/MS的分析方法并运用MRM模式检测。
-
对于CNS类和环肽类药物,EPSA有没有相应可以参考的阈值?
PSA越大,极性越大,越难透膜。有研究表明,PSA大于140 Å2的分子通常被认为在渗透细胞膜上较差。对于穿透BBB的分子(从而作用于中枢神经系统中的受体),PSA应小于60 Å2。对于EPSA高于100的环肽通常不会具有显著的被动渗透性。因此,为了筛选潜在的渗透性多肽,建议EPSA可作为工具,临界值为100。
-
EPSA作为评估渗透性的一项指标,它的保留和脂溶性(Log P)有关系吗?
EPSA保留是基于极性相互作用,独立于分子量和亲脂性(Log P)。
参考文献
- [1].
Goetz, G. H.; Philippe, L.; Shapiro, M. J. EPSA: a novel supercritical fluid chromatography technique enabling the design of permeable cyclic peptides. ACS Med. Chem. Lett. 2014, 5, 1167−1172.
- [2].
Palm K, Luthman K, Ungell AL, Strandlund G, Artursson P; J Pharm Sci. 1996, 85:32–39.
- [3].
Biron, E.; Chatterjee, J.; Ovadia, O.; Langenegger, D.; Brueggen, J.; Hoyer, D.; Schmid, H. A.; Jelinek, R.; Gilon, C.; Hoffman, A.; Kessler, H. Improving Oral Bioavailability of Peptides by Multiple NMethylation: Somatostatin Analogues. Angew. Chem. 2008, 47, 2595− 2599.
- [4].
Palm K, Stenberg P, Luthman K, Artursson P; Pharm Res. 1997, 14:568–571.
- [5].
Goetz, G. H.; Farrell, W.; Shalaeva, M.; Sciabola, S.; Anderson,D.; Yan, J.; Philippe, L.; Shapiro, M. J. High Throughput Method for the Indirect Detection of Intramolecular Hydrogen Bonding. J. Med.Chem. 2014, 57, 2920−2929
加入订阅
获取药物代谢与药代动力学最新专业内容和信息



















