-
平台介绍
-
研究模型与平台
-
经验
-
研究策略与实验
-
仪器设备
-
案例分享
-
常见问答
-
相关资源
-
相关服务
平台介绍
药明康德药物代谢与动力学部基于寡核苷酸药物研究经验,各国药监部门发布的关于寡核苷酸药物开发的注意事项,行业白皮书及前沿文献研究[1,2]建立起一套针对寡核苷酸药物的药代动力学评价体系。我们在临床前体外实验方法、体内药代实验设计等方面积累了丰富的研究经验,有能力开展放射性同位素标记的物质平衡及组织分布研究,提供多样化的寡核苷酸药物定量分析方法,具备代谢产物分析鉴定能力,同时在药代动力学研究策略、数据解读及跨部门合作上有着突出优势,可有效缩短寡核苷酸药物的开发周期。
了解更多

研究模型与平台
-
全面多样化的寡核苷酸生物分析平台
寡核苷酸的药代/药效动力学研究需要多元化的生物分析平台,来支持包括血浆/组织中的暴露量,组织分布,与细胞质中的RNA诱导沉默复合体结合的寡核苷酸浓度,靶向mRNA的降解效率,以及目标蛋白的抑制效率等等。我们有丰富的经验和多样化的仪器支持从早期药物筛选到IND申报的寡核苷酸生物分析,可以针对不同类型的寡核苷酸提供多种解决方案。

-
寡核苷酸体外ADME研究
寡核苷酸被广泛分布的核酸酶代谢,通过体外实验考察寡核苷酸药物在血液,靶组织和溶酶体中的稳定性,可以帮助评估寡核苷酸在循环系统和靶向器官中的稳定性,优化其化学修饰。同时考察血浆蛋白结合也对理解它们的PK/PD关系有帮助。药明康德DMPK已经建立了多种寡核苷酸的体外稳定性考察,包括血浆,血清,肝肾S9和匀浆,溶酶体等不同基质,能应用超滤法等不同方法对不同类型的寡核苷酸药物测定血浆蛋白结合率。

-
寡核苷酸体内PK研究
寡核苷酸目前最常见的系统给药方式为静脉注射和皮下注射,局部给药方式为鞘内给药,玻璃体注射,和常规小分子相比,其在靶组织(比如肝脏)的暴露量相比血药浓度对于寡核苷酸的药效有更好的相关性,也是在早筛小动物实验或者后期大动物实验中需要的。药明康德DMPK可在小鼠、大鼠、猴多个种属中开展不同给药方式的寡核苷酸体内PK,组织分布,排泄等实验,特别是对于鞘内注射途径有成熟的操作和高成功率,并且能开展大动物的活体肝脏穿刺,支持寡核苷酸的靶组织PK研究。

-
寡核苷酸代谢产物鉴定平台
药明康德DMPK已搭建良好相关的体内外代谢实验体系,包括体外孵育(血浆、S9、组织匀浆、细胞、溶酶体等)和体内基质(血浆、靶向组织以及排泄物等)的代谢研究。具备灵活的分析条件优化,由经验丰富的研究员通过人工筛选技术结合寡核苷酸专项软件,寻找代谢产物并鉴定代谢产物的结构。每年可完成100+的寡核苷酸MetID项目,包括多种结构修饰和有不同偶联物的ASO和siRNA。

创新模型|高效预测siRNA代谢
一项发表在DMD期刊的研究确定了理想的体外代谢模型,如肝素血浆和pH调节的肝系统,以准确预测GalNAc-siRNA在体内的代谢。这项研究提高了Inclisiran等疗法的临床前代谢研究的准确性,并能用于筛选和优化结构,加速寡核苷酸药物的开发。
经验
-
5+
年分析经验
-
20+
IND 申报项目
-
70+
Oligo全球客户
研究策略与实验
-
寡核苷酸药物种类多样,根据其作用机理、递送系统、化学修饰等的不同,其药代动力学性质呈现多样化。临床前开发应根据药物的特性,定制研究策略,加速寡核苷酸药物研发进程。在体外ADME研究中,需根据药物的结构特点选择合适的体外代谢模型;在体内PK研究中,可选择不同的给药方式进行PK性质的考察,并根据化合物性质选择合适的检测方法。

临床前发现 先导分子优化 | 临床前开发 支持临床候选分子表征和IND申报 | 临床开发 支持临床开发和NDA申报 | |
ADME | 血浆蛋白结合 S9代谢稳定性 血浆/血清稳定性 组织匀浆代谢稳定性 溶酶体代谢稳定性 肝细胞代谢稳定性 血浆/组织匀浆/S9/肝细胞代谢产物鉴定 | 血浆蛋白结合 组织匀浆代谢稳定性 血浆/血清稳定性 S9代谢稳定性及代谢产物鉴定 放射性标记的化合物在动物体内的ADME研究 动物体内样品代谢产物鉴定(组织、血浆、尿、粪、胆汁、脑脊液等) | 人血浆、尿液、粪便等代谢物鉴定 毒理动物中组织、血浆、尿、粪、胆汁等代谢物鉴定 |
DDI | 药物转运体抑制评估 CYP酶抑制研究(可逆性和时间依赖性抑制) CYP450酶诱导 | PBPK方法预测人体内的DDI风险 临床DDI研究 | |
PK | 在PD或毒理种属中的PK研究可伴随药效指标的检测 啮齿动物组织分布研究 | 啮齿动物中PK和组织分布研究 啮齿动物中尿、粪、胆汁排泄研究 非啮齿动物中PK研究和组织分布研究 | 人体内PK研究 免疫原性评估 人体内群体PK研究 |
仪器设备
-
-


Sciex Triple QuadTM 6500+
-


Q-ExvtiveTM Plus
-


Fluorescence Detectors
-


Molecular Devices SpectraMax M5e
-


QuantstudioTM 7 fLEX
-
案例分享
-
背景:Cemdisiran 是一个与 GalNAc 偶联的 siRNA,AS链3’ 端具有不对称 RNA/dTdT悬挂,靶向C5补体通路,通过抑制肝脏产生C5补体蛋白来治疗补体介导的疾病。
体内实验设计:我们按照常规的siRNA药物早期体内实验方案开展了小鼠的药代动力学研究,通过皮下注射单次给药后在多个时间点取血和肝脏进行分析。具体实验设计如图3所示: 设置低\中\高3个各剂量组,单次给药后,在1、6小时以及1、2、3、7、14和21天安乐小鼠以收集生物样品。

图1. siRNA-X小鼠药代动力学实验设计及生物分析解决方案
在这个实验中采用了3种不同的分析平台4个生物分析方法对样品进行分析:
1. 利用LC-MS/MS的方法对siRNA的血浆及肝脏浓度进行定量检测(图2);
2. 利用ELISA对血清中的C5补体蛋白水平进行检测(图3);
3. 利用RNA免疫沉淀配合茎环法RT-qPCR对肝脏中的RISC-siRNA的复合体浓度进行定量检测;
4. 利用茎环法RT-qPCR的方法对肝脏中靶基因进行检测。
通过对肝脏组织RISC-siRNA复合体进行检测,并与靶蛋白或是靶基因mRNA的抑制率/降解比较(图4和图5),可以发现RISC-siRNA复合体浓度而不是游离血浆药物浓度与靶细胞中基因沉默效应更加相关。我们成功地应用了不同的分析平台和方法完成了寡核苷酸的PKPD研究。
了解更多信息
-

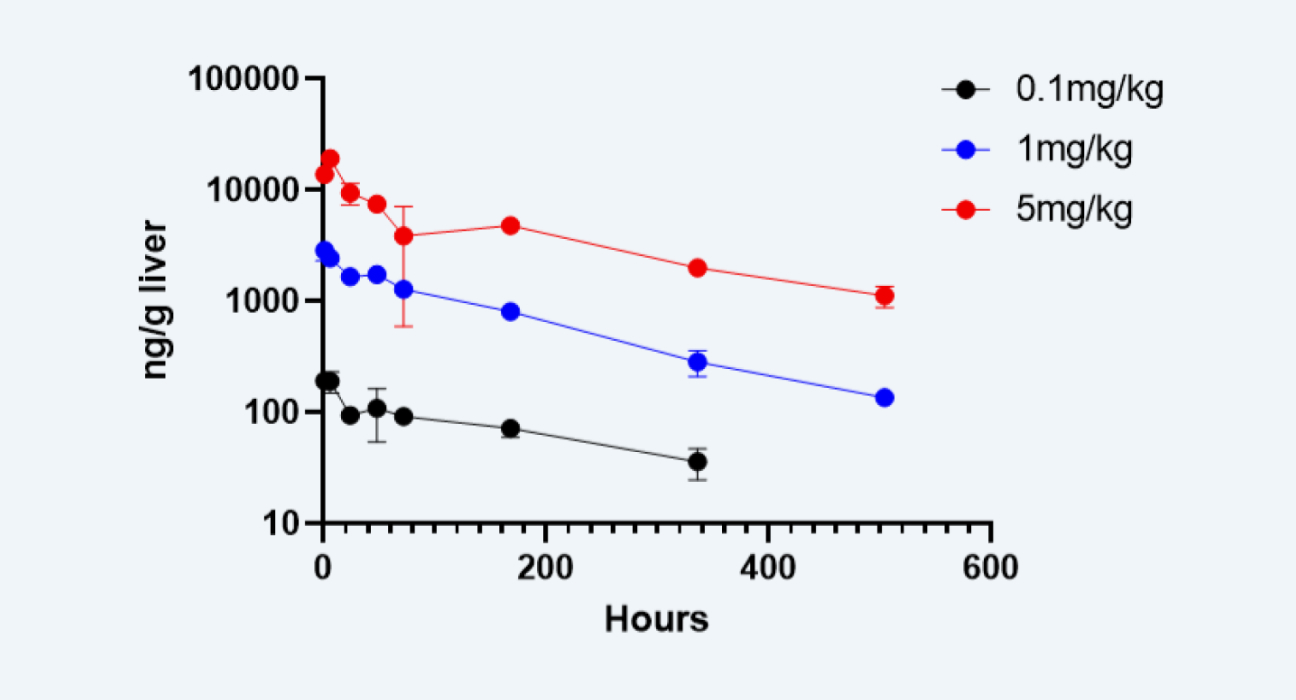
利用LC-MS/MS方法检测不同剂量组Cemdisiran在小鼠肝脏中浓度
图 2
-

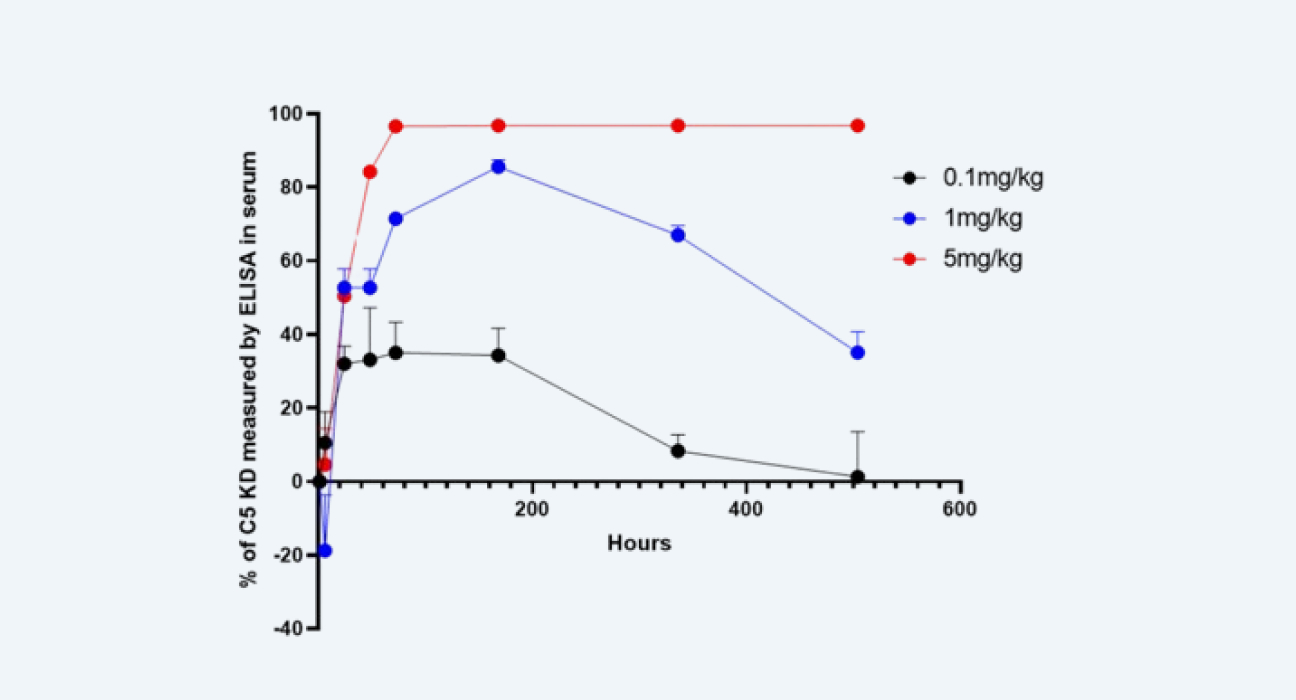
利用ELISA对血清中的C5补体蛋白水平进行检测
图 3
-

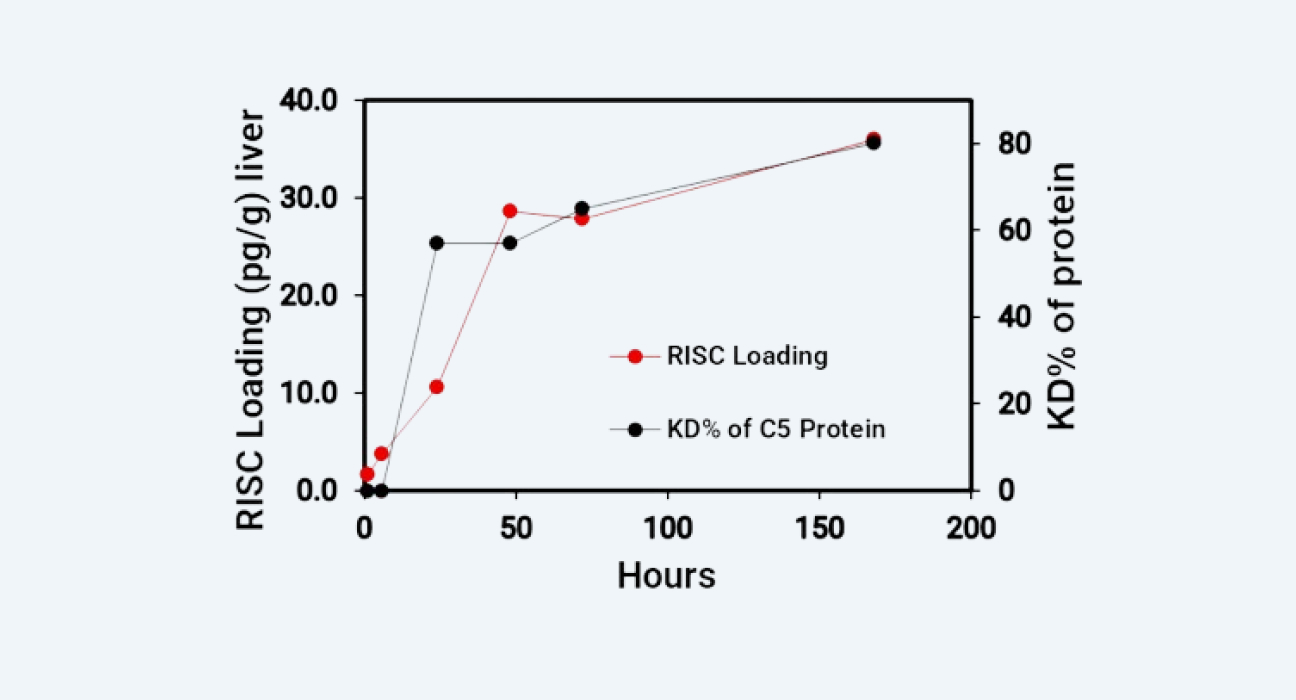
小鼠肝脏中RISC-siRNA复合体浓度 v.s. C5补体蛋白抑制率
图 4
-

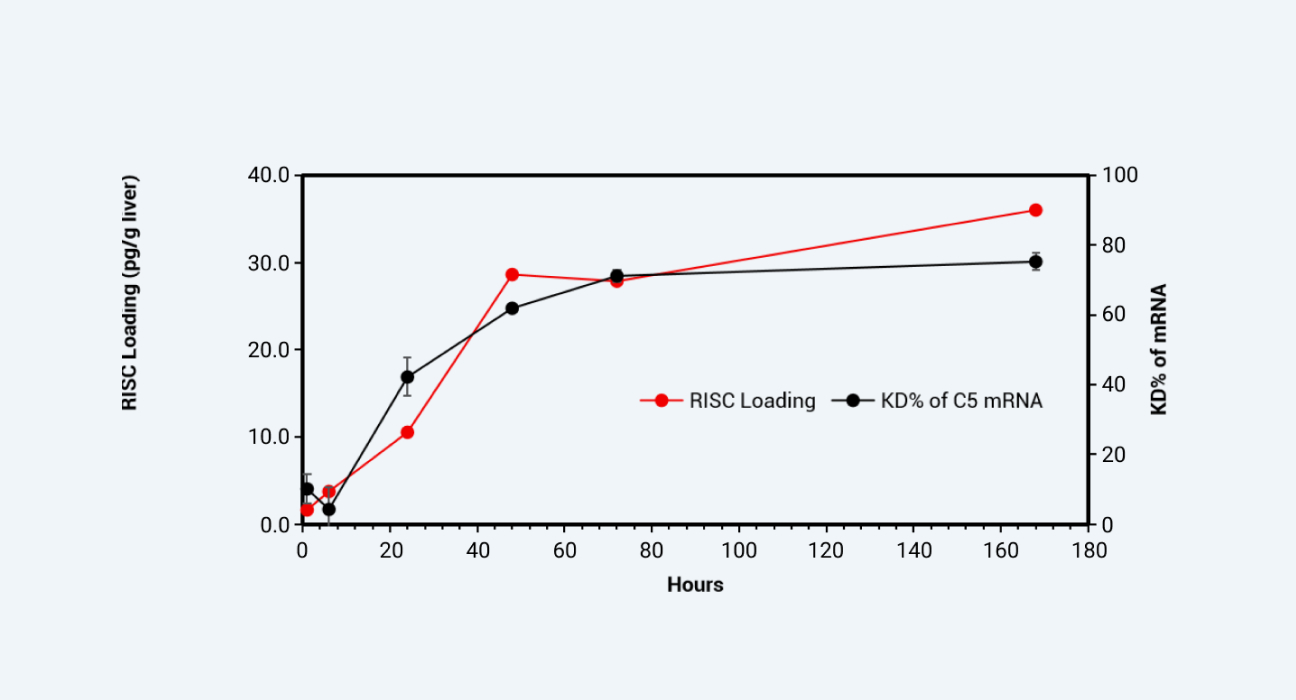
小鼠肝脏中RISC-siRNA复合体浓度 v.s. 靶基因mRNA降解效率
图 5
-
常见问答
-
什么是Oligo药物?
寡核苷酸药物是一种人工合成并经过化学修饰的核酸,可以通过一系列过程调节基因表达,主要包括小干扰RNA(siRNA)、反义寡核苷酸(ASO)、微RNA (miRNA)和核酸适配体。它们针对传统上无法治疗的致病基因和罕见疾病中患者特异性的基因缺陷有很大的治疗潜力。
-
Oligo药物的早期DMPK评价,推荐做哪些研究?
Oligo的早期DMPK评价,大致可以分为在体外不同基质的稳定性研究,以及药效相关种属的体内组织分布+PK/PD实验。药物的开发应该考虑采用platform-based approach,对于已经有较为成熟的修饰和递送方式的小核酸(比如GalNAc-siRNA),部分实验可以推迟或者只需要在IND阶段进行表征。对于具有新的化学修饰,递送平台的oligo,体外稳定性实验,代谢产物鉴定,以及PKPD实验在早期有更大的指导意义。
-
Oligo药物的临床前PK的动物种属如何选择?
寡核苷酸考虑到基因同源性的原因,而且都由核酸酶代谢,多种属间代谢差异小,小动物可以根据药效相关种属选择小鼠或者大鼠,大动物通常都是选择猴,能更好地预测在人体内的PK。
-
寡核苷酸和核苷酸有什么区别?
核苷酸和寡核苷酸的主要区别在于结构和应用。核苷酸是核酸(DNA/RNA)的基本单位,由磷酸基团、糖分子和含氮碱基组成。寡核苷酸是人工合成的短链核苷酸(通常13-25个单位),用于研究和医学领域,包括PCR扩增、诊断检测和靶向治疗等应用。核苷酸是生物系统中的基本结构单元,而寡核苷酸则是为特定科学和医学目的设计的工具。
相关资源




-


抗体‑寡核苷酸偶联物(AOC)的结构特征:抗体与寡核苷酸载荷的关键特征及其对功能的影响
文章2025-11-28查看更多 -


攻克寡核苷酸代谢研究挑战,加速创新药物研发-药明康德DMPK TechTalk
视频2025-11-14查看更多 -


寡核苷酸药物生物分析策略:一文读懂如何选择前处理方式
文章2025-06-20查看更多 -


DMD期刊发表:寡核苷酸药物多种体外代谢体系优化及其体内外相关性研究
文章2025-05-28查看更多 -


Comparative Metabolism of a GalNAc-Conjugated siRNA, Inclisiran, Among Various In Vitro Systems and Correlations with In Vivo Metabolism in Rats
出版物2025-05-08查看更多 -


寡核苷酸药物的体外代谢研究方法和策略
文章2025-01-07查看更多 -


寡核苷酸药物的体外代谢研究影响因素的评估
学术海报2024-12-03查看更多 -


寡核苷酸(Oligo)药物的代谢特征及体外代谢研究体系选择
文章2024-11-05查看更多 -


寡核苷酸偶联抗体(AOC)药物:靶向优势、药代动力学及生物分析策略
文章2024-10-25查看更多 -


反义寡核苷酸药物鞘内给药的药代动力学特征及评价策略
文章2024-07-10查看更多 -


寡核苷酸药物的血浆蛋白结合研究——意义、方法和策略
文章2024-07-04查看更多 -


siRNA药物非临床早期体内药代动力学研究中的一体化生物分析策略
文章2023-09-25查看更多 -


RT-qPCR技术在寡核苷酸DMPK定量分析中的应用
文章2023-09-25查看更多 -


上市siRNA药物ADME研究概况及数据解读
文章2023-09-21查看更多 -


解读 │ FDA 批准的反义寡核苷酸药物的吸收、分布、代谢和排泄特征
文章2023-09-13查看更多 -


液相色谱-荧光检测方法在寡核苷酸DMPK定量生物分析中的应用
文章2023-08-24查看更多 -


配体结合测定法(LBA)在寡核苷酸药代动力学定量分析中的应用
文章2023-08-02查看更多 -


寡核苷酸药物的“智能”递送
文章2023-07-28查看更多 -


液相色谱-质谱联用在寡核苷酸药代动力学定量分析的应用
文章2023-06-09查看更多 -


CDE发布纳米药物研究技术指导原则,哪些内容需要关注?
文章2023-06-07查看更多 -


寡核苷酸药物(OLIGO)药代动力学研究服务
宣传册2023-05-18查看更多 -


寡核苷酸类药物药代动力学中的定量分析技术
网络研讨会2023-05-17查看更多 -


寡核苷酸药物的代谢及代谢产物分析和鉴定研究
文章2023-05-17查看更多 -


如何应用药代动力学定量分析技术推进寡核苷酸药物研发?
文章2023-05-05查看更多
参考文献
- [1].
Berman, C. L., Antonsson, M., Batkai, S., Bosgra, S., Chopda, G. R., Driessen, W., Foy, J., Hassan, C., Hu, X. S., Jang, H. G., Meena, Sanseverino, M., Thum, T., Wang, Y., Wild, M., & Wu, J. T. (2023). OSWG Recommended Approaches to the Nonclinical Pharmacokinetic (ADME) Characterization of Therapeutic Oligonucleotides. Nucleic acid therapeutics, 33(5), 287–305. https://doi.org/10.1089/nat.2023.0011
- [2].
Guidance, D. Clinical Pharmacology Considerations for the Development of Oligonucleotide Therapeutics. Guidance for Industry. (2022)
加入订阅
获取药物代谢与药代动力学最新专业内容和信息