-
平台介绍
-
实验
-
动物种属
-
给药方式
-
手术模型
-
经验
-
设施
-
常见问答
-
相关资源
-
相关服务
平台介绍
我们团队根据客户需求以及对市场前瞻性的判断,现已开发出了30种以上的给药途径,10种以上的手术模型,为全球数以千计的客户提供了高质量的啮齿类动物体内药代动力学服务。在为客户持续赋能的同时,团队也建立了很多独具特色的技术能力,如连续7天以上的静脉输注(IV infusion)等。此外,团队在皮肤、呼吸系统、眼科、神经系统等方面也建立了很多高质量的药代动力学技术能力,并为客户解决很多项目难题。
了解更多


动物种属
-
小鼠
ICR (CD-1) 小鼠
C57BL/6 小鼠
BALB/c 小鼠
FVB 小鼠
BALB/c Nude 裸鼠
NOD SCID 小鼠
P-gp/BCRP KO Mouse 基因敲除小鼠
-
大鼠
Sprague Dawley 大鼠
Wistar Han 大鼠
Wistar 大鼠
Brown Norway 大鼠
F344(CDF) 大鼠
Lewis 大鼠
-
地鼠
叙利亚金黄地鼠
-
豚鼠
Harley Guinea Pig
给药方式
给药方式案例
-
-
胶囊给药
-
鞘内注射
-
7 天连续静脉注射
-
鼻腔给药
-
气管给药
-
吸入给药
-
迷你泵给药
-
玻璃体注射
-
侧脑室给药
-
静脉快速推注
-
缓慢注射泵推注
-
经口灌胃
-
肌肉注射
-
皮下注射
-
皮内注射
-
腹腔注射
-
肠内给药
-
舌下给药
-
皮肤给药
-
滴眼给药
-
关节腔注射
-
直肠给药
-
阴道给药
-
膀胱给药
-
-
经皮给药系统 (TDDS) 一直是富有吸引力的领域,因为它可以提供比全身递送更大的治疗窗口。外用皮肤制剂不仅被广泛地应用于局部给药,发挥局部作用,而且还可以通过皮肤吸收来发挥全身作用。评估药物经皮输送方法可分为两类:体内和体外 [1]。皮肤的吸收主要是被动扩散的过程,已经有较多的数据证明了使用适当条件进行体外实验研究获取的数据同样具有重要的参考价值。相较于较传统的体内实验,体外方法可测量化学物质滞留在皮肤内和经皮肤扩散到接收池中的药物浓度,用以探索早期筛选阶段的皮肤渗透性差异,并且该方法不使用活体动物,可以对相同或多个不同的化合物进行多次重复测量,特别适用于比较不同制剂中化合物的皮肤渗透行为及筛选不同化合物的透皮性能[2] 在巴马小型猪中进行的不同生产批次药物的体外透皮实验显示:受试制剂与参比制剂的体外经皮渗透特性没有显著性差异。
-

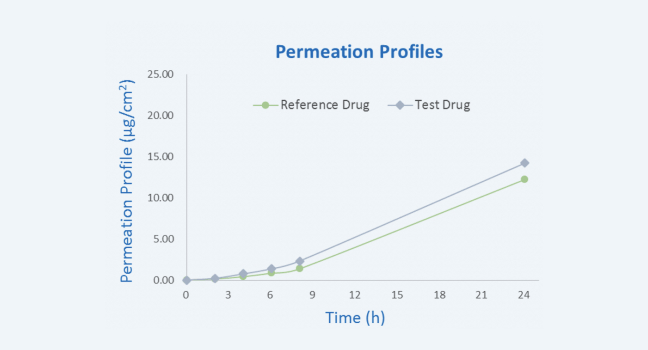
巴马小型猪皮肤中,化合物 24 小时渗透曲线
图 1
-

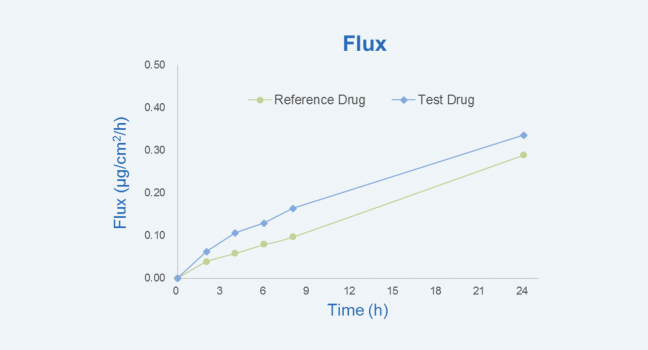
巴马小型猪皮肤中,化合物 24 小时渗透通量曲线
图 2
-

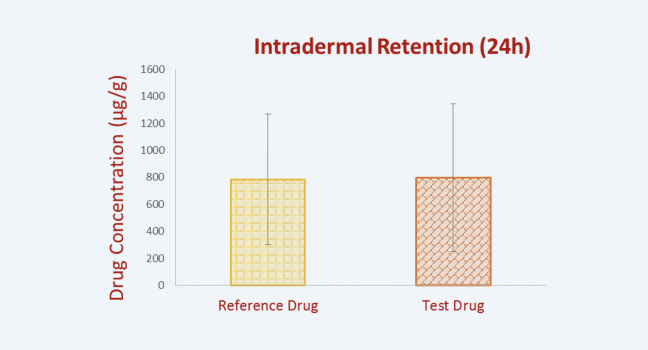
巴马小型猪皮肤中,化合物 24 小时皮肤内滞留量
图 3
-

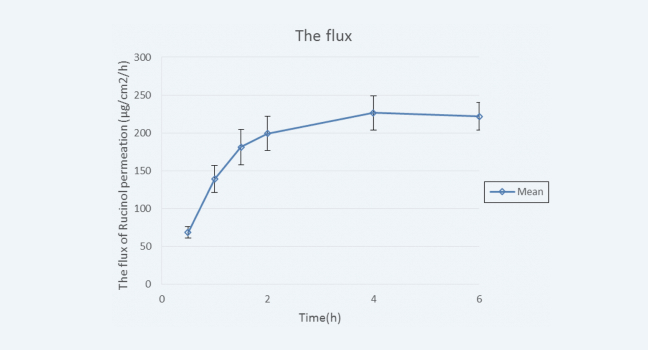
Strat-M® 人工膜中,化合物的渗透通量达到稳态
图 4
-
手术模型
手术模型案例
-
-
血管插管
颈动脉
颈静脉
股动脉
股静脉
肝门静脉
-
非血管插管
胆管
十二指肠
肠系膜淋巴
脑脊液插管
-
非存活性手术
小肠原位灌注
肝灌注
原位脑灌注
鼻粘膜灌洗
支气管肺泡灌洗
-
-
在体单向肠灌流模型 (SPIP) : 迄今为止,预测人体吸收过程最常用的模型是 Caco-2 细胞单层系统。虽然在 Caco-2 细胞系中药物通透性与人体内药物吸收有很好的相关性,但在载体介导的转运或监测肠道代谢产物时,Caco-2 对通透性的研究是有限的[3]。在体单向原位肠灌注 (SPIP) 是一种最能模拟口服给药的实验方法,它能够直接测定化合物吸收。人和啮齿类动物的肠结构相似,且两个物种间的 Peff 和 Fa 有较强的相关性(R2=0.8 至 0.95)。在体单向肠灌流模型能够很好的控制环境如药物浓度,灌注液 pH,灌注流速以及灌注的位置等。更重要的是,在体单向肠灌流模型是一种能够同时测量肠腔 (Peff) 和血液有效渗透系数 (Papp)的方法 [4,5]。目前团队可提供啮齿类动物的在体单向肠灌流模型来评估待测化合物的肠道通透性和监测其代谢产物研究的服务。
组别
受试化合物
文献
Peff (×10-6 cm/s)[6,7]
验证
Peff (×10-6 cm/s)
平均
Papp(×10-6 cm/s)
高渗透性
卡马西平
普萘洛尔
美托洛尔
62-160
41-69
14.3-50.285.60±20.54
59.69±7.31
23.71±0.9234.18±14.47
34.47±6.48
1.51±0.03中渗透性
雷尼替丁
地塞米松
阿替洛尔
14.7-30
16-24
1.8-1616.84±3.79
17.79±6.39
3.46±1.2013.77±6.64
3.82±0.82
3.15±1.36低渗透性
拓扑替康
纳多洛尔
1.7-55.8
2.7-5.31.70±2.91
3.52±8.8911.49±1.46
3.22±2.72
啮齿类动物生物样品采集清单
全血
血浆
血清
白细胞
红细胞
PBMC
眼部各组织*
脑部各组织* *
骨髓
全身脏器
肠液
胃液
肺泡灌洗液
关节灌洗液
鼻腔黏膜
脑脊液
脑脊液(大鼠多次连续)
淋巴液(手术)
胆汁(手术)
尿液(代谢笼)
粪便(代谢笼)
肠灌流液(大鼠,手术)
肝灌流液(大鼠,手术)
眼部各组织样品包括不限于:结膜、角膜、虹膜、晶状体、睫状体、视网膜、脉络膜、巩膜、视神经、房水、玻璃体。
脑部各组织样本包括不限于:纹状体,小脑、大脑皮质、海马、下丘脑、脑下垂体、中脑、延髓、视神经、视神经交叉、脑桥、脊髓。
经验
-
18+
年项目经验
-
280+/年
小动物IND PK项目
-
10,000+/年
小动物筛选类PK项目
设施
小动物PK团队共有3个动物设施,分别位于上海、苏州及南京。所有动物设施均为屏障系统,并获得AAALAC International的认可。此外,上海及苏州动物设施还拥有OLAW Animal Welfare Assurance认证。设施内主要有SPF级别的动物包括大鼠、小鼠、豚鼠及地鼠,并可支持2200只/周的PK项目通量。
-


AAALAC证书
-


手术室
-


自动采血仪
-


脉动真空灭菌器
-


走廊
-


自动洗笼机
-


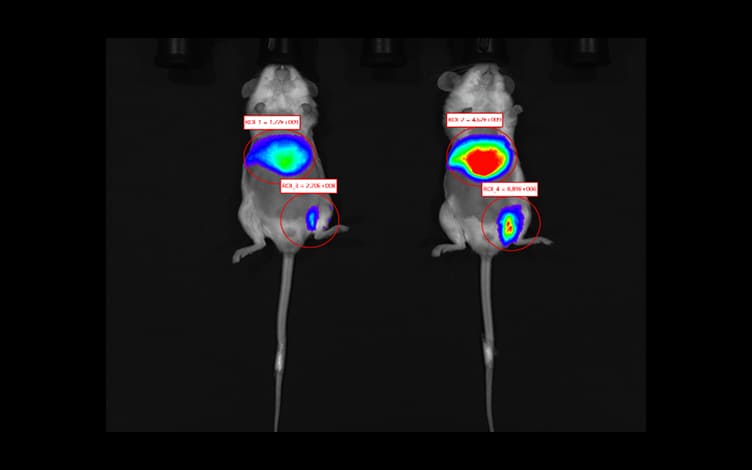
活体成像仪
了解我们更多的设施
包括小鼠,大鼠,地鼠,猴,犬,猪,兔等
常见问答
-
什么是啮齿类动物药代动力学?
啮齿动物药代动力学 (PK) 研究评估化合物在啮齿动物中吸收、分布、代谢和排泄的过程。这些研究有助于确定适当的药物暴露量、选择剂量并确定其他PK参数以支持药效和毒理研究。
-
PK研究中常用的啮齿类动物有哪些?
在啮齿动物PK研究中,最常用的动物是小鼠和大鼠,其次是仓鼠和豚鼠。
-
你们在小动物neuro PK方面都有哪些项目能力?
我们在小动物neuro PK方面有丰富的经验,我们可以进行侧脑室给药,也可以采集大小鼠的脑脊液,并可分离不同脑组织。
-
你们在小动物呼吸系统给药方面有哪些优势?
我们在小动物呼吸系统给药方面也有丰富的经验,如在鼻腔给药、气管给药、吸入给药等具有强大的技术能力,已为客户提供了很多高质量的项目服务。
相关资源




-


麻醉药在啮齿类动物药代动力学研究中的应用
文章2025-11-07查看更多 -


小动物活体成像技术:揭秘药物在体内的“生命轨迹”
文章2025-10-31查看更多 -


微透析技术在药代动力学研究中的应用
文章2025-09-26查看更多 -


从腰椎到大脑:大鼠鞘内插管技术助力中枢神经系统(CNS)药物精准递送
文章2025-06-03查看更多 -


啮齿类动物PK研究-第一部分不同种属的给药方式
宣传册2024-11-12查看更多 -


在体单向肠灌流(SPIP)模型在口服药物肠道吸收研究中的应用
文章2024-09-30查看更多 -


One mouse One PK系统助力生物药DMPK研究
文章2024-09-26查看更多 -


解读丨大鼠肠系膜淋巴管插管模型验证渗透促进剂SNAC对淋巴吸收的影响
文章2024-08-01查看更多 -


无菌动物——肠道微生物研究新工具
文章2024-06-28查看更多 -


吸入给药临床前体内药代动力学研究
文章2024-01-18查看更多 -


眼科药物临床前体内PK研究:给药、采样、检查及制剂策略
文章2023-10-03查看更多 -


液相色谱-质谱联用在寡核苷酸药代动力学定量分析的应用
文章2023-06-09查看更多
参考文献
- [1].
Guideline, O. E. C. D. 428-Guideline for the Testing of Chemicals-Skin Absorption: in vitro Method." Organization for Economic Cooperation and Development, Paris (2004)
- [2].
Oh, Luke, et al. In Vitro Skin Permeation Methodology for Over-The-Counter Topical Dermatologic Products." Therapeutic Innovation & regulatory science 54.3 (2020): 693-700
- [3].
Kim, J.S., Mitchell, S., Kijek, P., Tsume, Y., Hilfinger, J. and Amidon, G.L., 2006. The suitability of an in-situ perfusion model for permeability determinations: utility for BCS class I biowaiver requests. Molecular Pharmaceutics, 3 (6), pp.686-694
- [4].
Chiou, W.L. and Barve, A., 1998. Linear correlation of the fraction of oral dose absorbed of 64 drugs between humans and rats. Pharmaceutical Research, 15 (11), p.1792
- [5].
Cao, X., Gibbs, S.T., Fang, L., Miller, H.A., Landowski, C.P., Shin, H.C., Lennernas, H., Zhong, Y., Amidon, G.L., Lawrence, X.Y. and Sun, D., 2006. Why is it challenging to predict intestinal drug absorption and oral bioavailability in humans using the rat model. Pharmaceutical Research, 23 (8), pp.1675-1686
- [6].
Salphati, L., Childers, K., Pan, L., Tsutsui, K. and Takahashi, L., 2001. Evaluation of a single-pass intestinal perfusion method in rats for the prediction of absorption in man. Journal of pharmacy and pharmacology, 53 (7), pp.1007-1013
- [7].
Dahlgren, D., Roos, C., Sjögren, E. and Lennernäs, H., 2015. Direct in vivo human intestinal permeability (Peff) determination with different clinical perfusion and intubation methods. Journal of pharmaceutical sciences, 104 (9), pp.2702-2726
加入订阅
获取药物代谢与药代动力学最新专业内容和信息