-
平台介绍
-
实验
-
动物种属
-
给药方式
-
手术模型
-
经验
-
设施
-
常见问答
-
相关资源
-
相关服务
平台介绍
自2007年以来,药明康德药物代谢与动力学部一直为全球药物开发机构提供卓越的大动物药物代谢测试服务。我们拥有包括猴、狗、猪、兔和雪貂在内的多个动物种类,可满足各种多样化的实验需求。我们的数字化和智能化工作模式,结合先进的设备和电子数据管理,确保数据的真实、准确和可靠。我们有在职多年经验丰富的专业人士,可提供专业的分析和有效的解决方案。我们始终将客户满意度、严谨的科学方法和精准的操作作为首要任务。通过我们的创新服务,我们致力于提升药物开发效率,加速药物上市进程。让我们携手合作,推动药物开发,为人类健康贡献力量。
了解更多


实验
-
苗头化合物到先导化合物
快速筛选:
如大动物PK-口服或者静脉注射,单独或者联合给药
-
先导化合物优化
大动物PK(口服、静脉注射、短期静脉输液或72小时连续静脉泵注、皮下、肌肉和鞘内给药)
单次或多次给药
不同剂型的暴露量研究
-
候选化合物确立
特定给药方式的单次给药或多次给药实验
不同盐型或晶型的PK 实验
不同剂型的PK 实验(片剂、胶囊、固分体、纳米制剂、自乳剂),包括临床制剂的桥接实验
食物效应实验(高脂饲料,维持饲料)
胃酸pH调节PK实验(五肽胃泌素、法莫替丁)
最大耐受剂量实验(MTD),爬坡实验(DRF)
-
IND 申报实验
单剂量单次静脉给药PK 实验
高、中、低三个剂量单次口服给药PK 实验
中剂量多次口服给药PK 实验
单次口服给药组织中分布研究
中剂量单次口服给药胆汁排泄研究
中剂量单次口服给药尿液及粪便排泄研究
血浆和排泄种属主要代谢产物鉴定
动物种属
-
犬
比格犬
-
猴
食蟹猴
猕猴
狨猴
-
猪
巴马小型猪
-
兔
新西兰大白兔
青紫蓝兔
荷兰兔
日本大白兔
-
雪貂
Sable雪貂
给药方式
给药是体内药代动力学研究的重要组成部分。在早期药物筛选和后期药物开发中,选择合适的给药途径具有重大意义。根据客户需求和前瞻性的市场策略,我们已经开发出多种给药途径,为全球数千客户提供高质量的体内药代动力学研究服务。我们具备专业且高质量的给药技术,包括但不限于如口服给药,静脉快速推注给药,动物非麻醉状态下连续72小时静脉输液,眼部给药,经皮给药,鞘内注射等等。我们始终致力于提供更好的服务和持续的改进。
-
-
神经系统给药
脑室内给药(侧脑室给药)
腰椎穿刺给药(鞘内给药)
-
皮肤给药
皮内注射
皮肤给药(油膏,贴片,凝胶,膜剂,喷剂)
-
静脉注射
长时间静脉注射
肝门静脉注射
静脉快速注射
-
眼部给药
玻璃体注射
前房注射给药
滴眼给药
-
口腔给药
舌下给药(液体)
口腔颊内贴片
舌下贴片
口崩片
-
肠内给药
十二指肠给药
空肠给药
回肠给药
盲肠给药
结肠给药
直肠给药
-
鼻内(喷雾,滴剂)
-
关节腔
-
腹腔注射
-
阴道给药
-
骨内给药
-
膀胱给药
-
-
手术模型
手术模型案例
大动物PK手术模型是药物药代动力学研究的重要工具,通过建模可以进行复杂给药或者样品采集,帮助研究者对药物在体内的吸收、分布、代谢、排泄等过程有更深入的理解。药明康德药物代谢与动力学部具有专业的手术兽医人员,拥有十几年大动物手术模型开发和操作的经验,能够提供精准、可靠的手术模型服务,为药物研发提供有力支持。
-
-
小脑延髓池插管
-
胆管插管
-
肠插管
-
淋巴管插管
-
门静脉插管
-
-
对于直接作用于中枢神经系统的药物,准确检测脑中药物浓度可以更为准确的评估药物到达靶标的能力;与比利用血浆游离药物浓度预测脑组织中游离药物浓度相比,脑脊液(CSF)中药物浓度有更好的预测性[1][2]。检测 CSF 药物浓度可以作为体内评估中枢神经系统药物系统暴露量的有效指标,并为候选药物进入下一阶段提供重要依据。我们自 2009 年依照文献[3]建立了犬、猴脑脊液插管动物模型,可在动物非麻醉状态下连续多次采集 CSF 样本,获取相关的 PK 曲线,评估药物穿透入脑的能力。管子通畅最长维持时间超过 2 年,并在设施内长期备库该模型动物供项目快速开展,减少手术和动物恢复需要的等待时间。截止 2023 年已完成包含 IND 申报在内项目近 500 个。
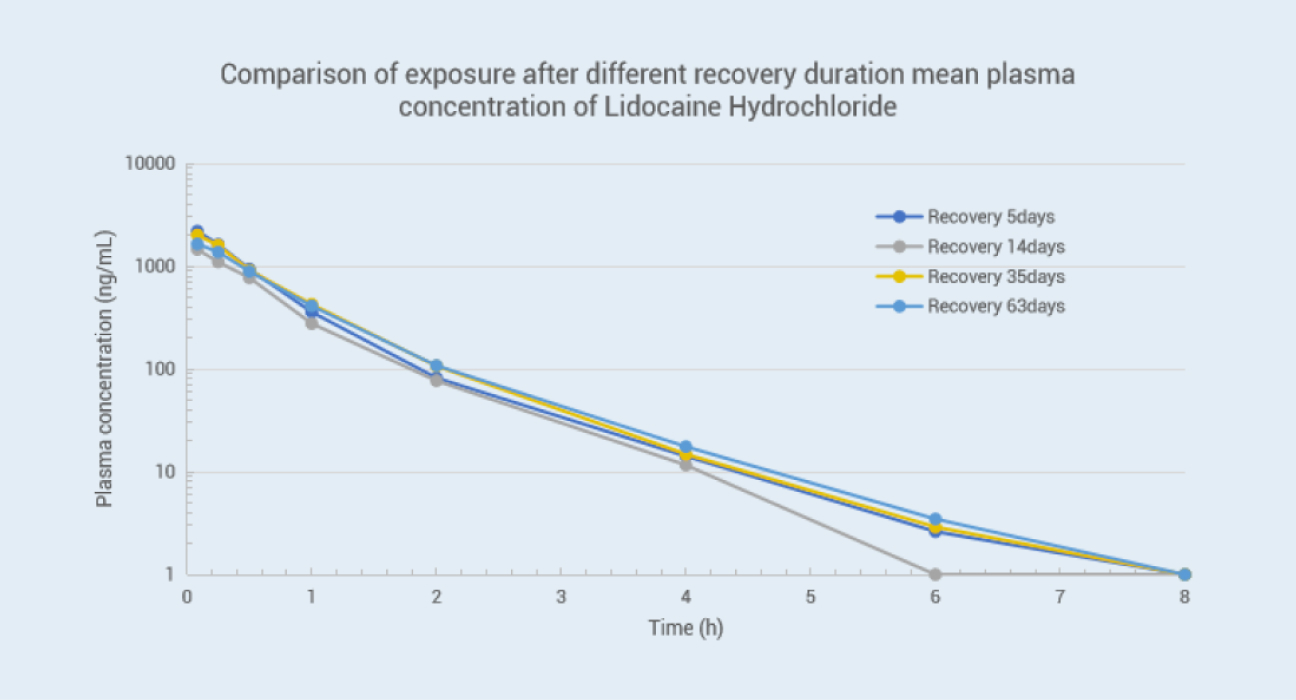
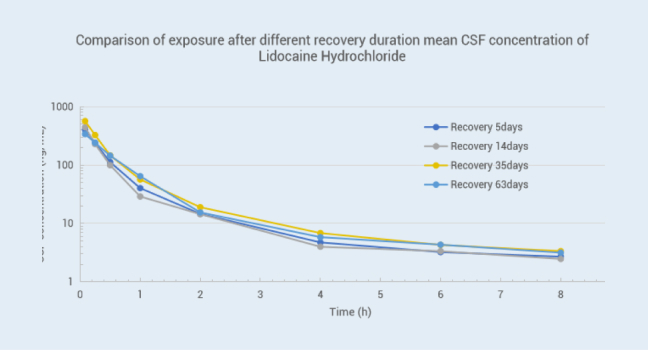
目的: 比较脑脊液插管手术犬术后不同恢复时间模型的稳定性
方法: 比格犬(3 只,雄性)脑脊液插管手术后不同恢复时间分别静脉注射盐酸利多卡因注射液(25mg/ 犬),按设定的时间点同时采集血浆与脑脊液样本并检测药物浓度,结果如下:
结论:由数据可以看出术后第 5 天、14 天、35 天、63 天,血浆及 CSF 基质中药物浓度偏差较小,由此可以说明我司动物手术模型稳定,数据重现性好。
了解更多
-
大动物生物样品采集清单
全血
血浆
血清
白细胞
红细胞
PBMC
角质层
表皮
真皮
皮下组织
眼部各组织*
脑部各组织* *
骨髓
全身脏器
肠液
胃液
肺泡灌洗液
关节液
直肠黏膜
口腔黏膜
鼻腔黏膜
脑脊液
脑脊液(多次连续)
淋巴液(手术)
胆汁(手术)
尿液(代谢笼)
尿液(穿刺)
尿液(插管)
粪便(代谢笼)
活检的皮肤,肌肉,肝组织
眼部各组织样品包括不限于:结膜、角膜、虹膜、晶状体、睫状体、视网膜、脉络膜、巩膜、视神经、房水、玻璃体、眼泪。
脑部各组织样本包括不限于:尾状核、小脑、大脑皮质、大脑白质、扣带回、扣带沟、胼胝体、外囊、内囊、苍白球、海马、下丘脑、脑下垂体、中脑、延髓、视神经、视神经交叉、脑桥、壳、脊髓。
经验
-
17+
年经验
-
100+
IND申报项目每年
-
20000+m2
动物设施面积
-
3,000+
只备用动物
设施
AAALAC认证动物设施,备库动物包括猴、犬、小型猪、兔、雪貂。
-


AAALAC 证书
-


手术室
-


水果间
-


走廊
-


洗笼间
-


解剖室
-


饲料间
-


欧标犬运动场
-


猪运动区域
-


欧标猴笼
了解我们更多的设施
包括小鼠,大鼠,地鼠,猴,犬,猪,兔等
常见问答
-
什么是大动物(非啮齿类动物)PK?
大动物PK(药代动力学)研究是指研究药物在大动物(非啮齿类动物)体内的吸收、分布、代谢和排泄过程。
-
为什么用大动物(非啮齿类动物)做PK研究?
这种研究是临床前药物开发的重要部分。大动物的生物系统与人类更为相似,能更准确地预测药物在人体内的行为,相较于小动物(如啮齿类动物),更具参考价值。
相关资源




-


The Role of Lymphatic Transport on the Systemic Bioavailability of the Bcl-2 Protein Family Inhibitors Navitoclax (ABT-263) and ABT-199
出版物2026-01-23查看更多 -


非人灵长类脑微透析技术:提升CNS药物脑部预测准确性
文章2025-09-30查看更多 -


宠物药品研发现状及其药代动力学研究
文章2025-02-06查看更多 -


大动物(非啮齿类)PK研究-第二部分手术模型
宣传册2024-11-12查看更多 -


食物对药物的体内过程有哪些影响?如何进行临床前评估?
文章2024-07-26查看更多 -


反义寡核苷酸药物鞘内给药的药代动力学特征及评价策略
文章2024-07-10查看更多 -


助力神经系统药物研发:大动物PK中的探索与应用
文章2024-05-15查看更多 -


眼科药物临床前体内PK研究:给药、采样、检查及制剂策略
文章2023-10-03查看更多 -


肝穿刺活检术在新药研发大动物PK中的应用
文章2023-05-11查看更多 -


透皮给药制剂研究概况及其体内PK研究方法
文章2023-05-05查看更多
参考文献
- [1].
Maurer TS, DeBartolo DB, Tess DA, Scott DO (2005) Relationship between exposure and non-specific thirty-binding of three central nervous system drugs in mice. Drug Metab Dispos 33:175-181
- [2].
Liu X, et al. (2009) Unbound drug concentration in brain homogenate and cerebral spinal fluid at steady state as a surrogate for unbound concentration in brain interstitial fluid. Drug Metab Dispos 37:787-793
- [3].
Gilberto DB, Zeoli AH, Szczerba PJ, Gehret JR, Holahan MA, Sitko GR, Johnson CA, Cook JJ, Motzel SL. Contemp Top Lab Anim Sci. 2003 Jul; 42 (4): 53-9
加入订阅
获取药物代谢与药代动力学最新专业内容和信息