多肽药物因其高活性、高特异性、低副作用以及与抗体类药物相比更低的生产成本而备受青睐。然而,因分子量大、极性表面积高、酰胺键易水解等原因,其代谢稳定性、膜渗透性和口服生物利用度较差,限制了多肽药物的发现与开发。近年来,噬菌体展示和mRNA展示等技术的发展推动了多肽文库在药物开发中的应用,使理性设计成为发现多肽的重要手段。
多肽药物根据其结构特征可分为线性肽和环肽。研究发现环肽在类药性上具有一定优势,如构象稳定、无不稳定末端氨基酸残基和分子内氢键形成,这些特性使环肽极性低、亲和力强、稳定性高,并提高了渗透性,可被用于口服给药或者作用于细胞内靶点。截至2024年6月,共有66个环肽药物获得批准,其中39个在2000年之后获批[1]。2023年批准的6款多肽药物中,有3款是环肽药物:瑞扎芬净(Rezafungin),用于治疗念珠菌血液感染的棘白菌素药物;莫替福肽(Motixafortide),首款靶向趋化因子受体CXCR4治疗多发性骨髓瘤的多肽药物;泽勒普肽(Zilucoplan),首个皮下注射补体C5多肽抑制剂,也是目前唯一可自行给药的全身型重症肌无力(gMG)疗法。根据Research and Markets的一份最新报告,大环肽和订书肽(本质上也属于环肽)药物市场将从的12.2亿美元(2024年)增至47.6亿美元(2030年),复合年增长率为21.44%。尽管环肽具有潜在的优势,但代谢稳定性和膜渗透性差等主要障碍仍需解决。下文分别从这两方面来了解环肽的相关研究。
表1. 环肽与线性肽的性质比较
性质 | 环肽 | 线性肽 |
构象 | 受限 | 灵活 |
末端氨基酸 | 否 | 是 |
氢键 | 分子内 | 分子间 |
极性 | 较低 | 较高 |
亲和力 | 较高 | 较低 |
稳定性 | 较高 | 较低 |
渗透性 | 较高 | 较低 |
口服给药 | 可能 | 较不可能 |
细胞内靶点 | 可能 | 较不可能 |
提高环肽稳定性
提高环肽的稳定性主要采用以下几种方法。
修饰肽链的骨架,包括使用D-氨基酸、非蛋白源性氨基酸、β-/γ-氨基酸和N-甲基化。生物电子等排体修饰可能在不影响活性的情况下产生最佳结果。
筛选合适的环化形式以及双环化,可以降低构象柔性,减少因外肽酶催化引起的代谢。
二级结构可以通过α-螺旋、β-链和环、分子内氢键和订书结构,或者通过使用α/β-肽来维持和增强螺旋度。
生长激素抑素(Somatostain)是一种14肽的环肽激素,主要由下丘脑促垂体区细胞分泌,胰岛D细胞、胃肠道也可产生。其体内半衰期很短,很难用于疾病治疗。根据稳定性研究改造其结构,用D-氨基酸替换L-苯丙氨酸和L-色氨酸,将C端羧基变换成醇基,同时保留药效团,最终得到8肽类似物奥曲肽(Octreotide)。改造后可以减少内肽酶的催化作用,将半衰期从3分钟延长到100分钟[2],已上市用于治疗肢端肥大症、腺瘤和胰腺、乳腺、前列腺肿瘤。
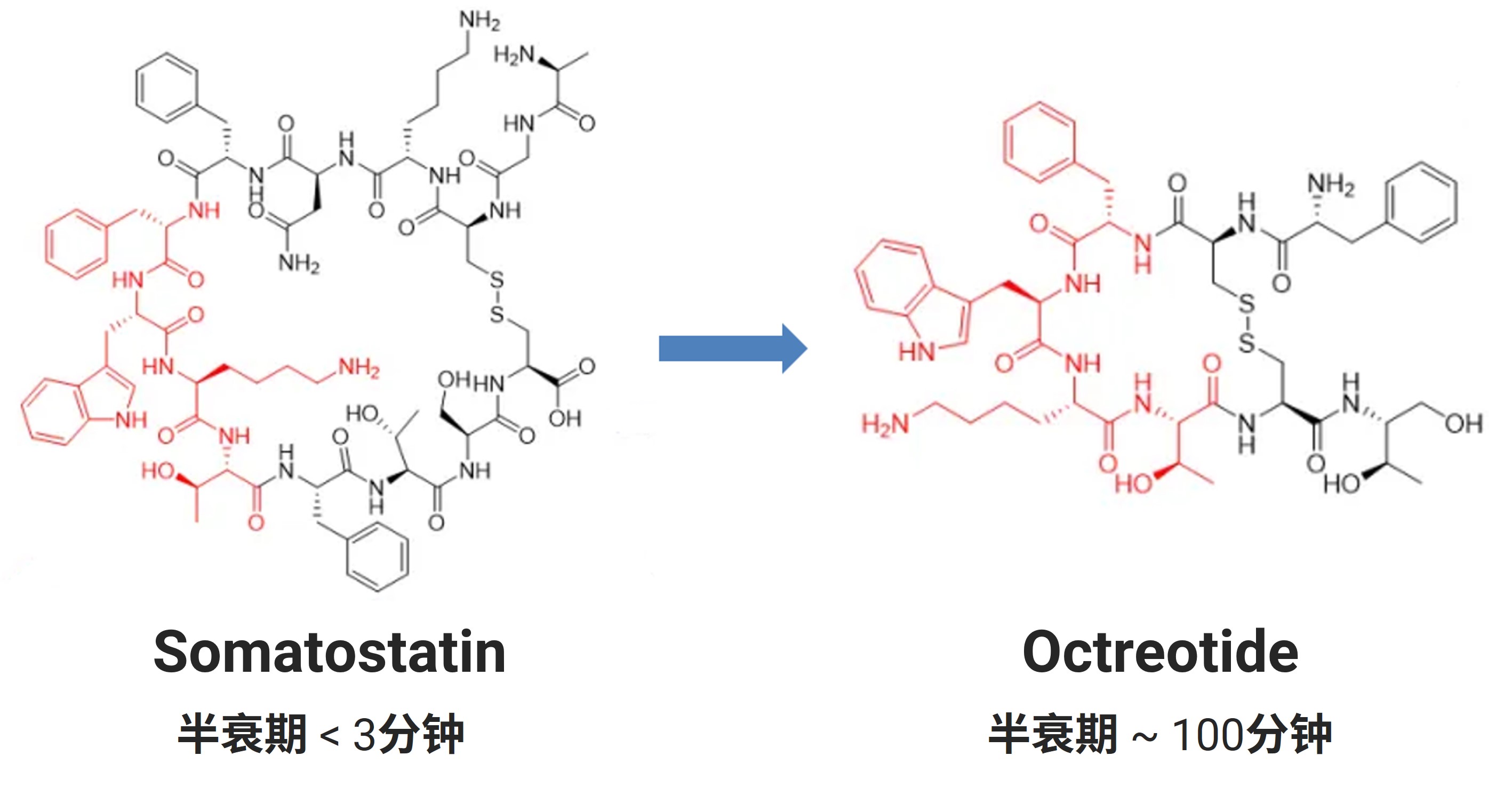
图1. 生长激素抑制素修饰成为奥曲肽(红色为药效基团)
在单环肽的基础上,科学家采用双环策略开发出与尿激酶纤溶酶原激活物结合的多肽,结果显示双环肽比其线性和单环对应物更稳定,在鼠血浆中孵育24小时后仍有40%原药存在[3]。

图2. 双环肽的连接方式[3]
提高环肽膜渗透性
被动渗透是药物穿过生物膜的主要途径,它通常需要分子量小、脂溶性好等特点。Christopher A. Lipinski和同事在1997 年发布了开发口服小分子药物的理化性质类药5原则,后来又有研究增加了极性表面积变成“扩展的5原则”。含有6个以上残基的多肽明显超过了这些限度,然而这并不意味着多肽不能透过生物膜。研究者在自然界丰富多样的环肽中发现了一些渗透性良好的分子。
表2. 基于上市口服小分子药物理化性质的“扩展的5原则”
属性 | 扩展的5原则 |
分子量 | < 500 Da |
氢键受体数量 | < 10 |
氢键供体数量 | < 5 |
LogP | < 5 |
可旋转键数量 | < 10 |
极性表面积 | < 140 Ų |
环孢素 A 是从真菌Tolypocladium inflatum中分离得到的一种环肽。尽管其特性超过了扩展的5原则,但令人惊讶的是其表现出异常好的稳定性和渗透性,口服生物利用度在20%-70%之间。这可能归因于Nα-甲基化和非蛋白氨基酸的替代。另一个关键机制涉及其“变色龙”行为。环孢素分子可以根据周围环境调节构象。当进入脂质双层时,它可以内化极性原子,当扩散到水性细胞内环境时,它恢复到活性构象。
环孢素 A 的案例激发了对超出扩展 5 原则的化合物的研究。其中一项研究建立了一个环肽和类肽数据库,如图所示,其中两个理化参数EPSA(experimental polar surface area)和ClogP与环肽通透性相关[4]。观察到,虽然EPSA值低于90 Å2不能保证良好的渗透性,但它确实显著改善了化合物的前景。CLogP值在7.5和10之间有利于渗透性,因为亲脂性更高或更低均会对渗透造成障碍。几项研究揭示了环肽的相似边界,如表3所列。这些发现可以为合理设计环肽提供一个很好的起点。
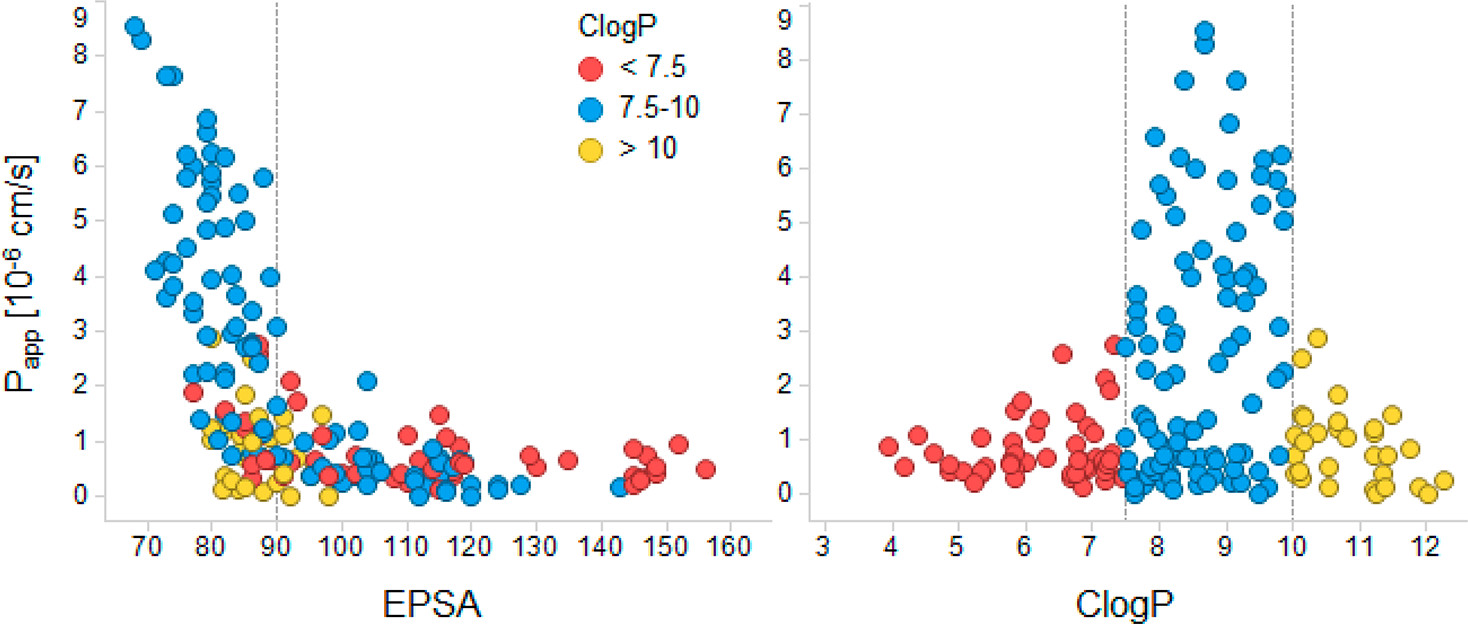
图3. EPSA, CLogP与MDCK细胞渗透性的相关分布[5]
表3. 环肽药物设计的超越5原则[6]
属性 | 超越5原则 |
分子量 | < 1000 Da |
氢键受体数量 | < 15 |
氢键供体数量 | < 6 |
LogP | 7.5-10 |
可旋转键数量 | < 20 |
极性表面积 | < 250 Ų |
EPSA | < 90 Ų |
N-甲基化可以修饰环肽的构象、氢键结合电位和亲脂性,得到适宜的理化性质从而增强其膜通透性。例如Veber-Hirschmann肽,一种生长抑素合成类似物,该类似物保留了生长抑素的活性序列,并表现出受体选择性,再通过N-甲基化修饰开发得到一个新的类似物,使其Caco-2渗透性从1 x 10^-6 cm/s提高到4 x 10^-6 cm/s[7]。
另一种有前景的方法是细胞穿透肽(CPPs),在20世纪90年代初被发现,此后已鉴定出近2000种具有细胞穿透活性的多肽。其中,环状CPPs与线性CPPs相比,表现出优越的稳定性和胞质转运效率。环状CPPs直接与质膜磷脂结合,通过内吞或直接转位进入细胞。因此,它们可以作为载体来运输多肽药物。内环偶联法可以将线性肽和小肽与环状CPPs融合,而外环和双环偶联法适用于较大的多肽和环肽。对于某些靶蛋白,肽配体必须呈线性形式才能具有生物活性。因此,可逆性环化或双环化偶联法被设计用于在胞质中释放线性肽,以进行靶向结合[8]。

图4. 细胞穿透肽1(CPP1)[8]
口服环肽药物开发
心血管病是全球人口死亡的首要原因,而高胆固醇血症是引起动脉粥样硬化性心血管病(主要包括冠心病和缺血性卒中)的重要危险因素。降血脂的主要治疗药物包括他汀类、贝特类药物,而约50%使用他汀类药物的个体无法将其低密度脂蛋白胆固醇(LDL-C)水平降低至预期水平,并且面临不良反应多、需要联合给药、长期服药等问题。近年来,PCSK9抑制剂为各类难治性高胆固醇血症患者提供了新的治疗方法和希望,其通过降解LDL-C来调控血脂。目前全球共上市3款PCSK9抑制剂,包括依洛尤单抗(Evolocumab)、阿利西尤单抗(Alirocumab)两款单抗,及一款小核酸药物英克司兰(Inclisiran),展现出超越他汀类药物的安全性和治疗效果。依洛尤单抗2022年销售额已达到12.96亿美元,其他两款药物也有望成为10亿美元的重磅药物。但这三款药物也存在皮下注射依从性差、价格昂贵等限制,因此开发新型口服PCSK9抑制剂成为热点。
MK-0616是一款口服环肽PCSK9抑制剂,用于治疗成人高胆固醇血症。2023年8月已经启动三期临床试验,有望成为首款口服PCSK9抑制剂。其研发过程首先通过mRNA展示技术发现苗头多肽化合物,再基于结构的药物设计进行优化获得最终的分子。化合物44易受大环化过程中掺入的硫化物的化学氧化影响,重要修饰是取代巯基接头和中央三唑(红色至蓝绿色),以最大限度地减少氧化敏感性(44 = 98%,MK-0616 = 2.9%),同时保持效力(44 Ki = 2 pM,MK-0616 Ki = 5 pM),并将烯烃更改为酰胺交联剂以增加溶解度(通过降低亲脂性)并避免烯烃形成产生的异构体[9]。
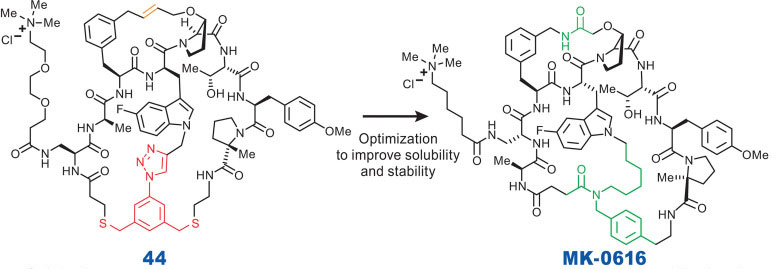
图5. 先导化合物44结构优化为MK-0616 [9]
在被动渗透性测定中,MK-0616的跨细胞渗透性(Papp)非常低(0.71 x 10-6 cm/s)。临床试验制剂中使用癸酸钠(sodium caprate)或辛酸癸酸聚乙二醇甘油酯(Labrasol)作为渗透促进剂增加肠道吸收,在200 mg剂量下,含有Labrasol的制剂与不含Labrasol的制剂相比,MK-0616的Cmax高出5倍(45.3 nmol/L 比7.84 nmol/L), AUC0-inf高出2倍(1250h·nmol/L比556 h·nmol/L)。100 mg剂量下含有Labrosol和癸酸钠的暴露量类似,生物利用度约2%。在10到300 mg剂量范围内,AUC0-inf 低于剂量线性增长,半衰期为35小时至130小时左右。
高脂肪早餐(55.6 g脂肪、55 g碳水化合物、31.1 g蛋白质)后30分钟给予40 mg剂量的MK-0616,其AUC0-inf和Cmax与在禁食条件下给予相同剂量的几何均值比值(进食/禁食)分别为0.33和0.25,说明进食条件不利于其口服吸收。

图6. MK-0616单次给药后血药浓度曲线[9]
在二期临床试验中,MK-0616每天一次给药8周后显示出安慰剂调整后的LDL-C(低密度脂蛋白胆固醇)降低,具有统计学意义和稳健的剂量依赖性,从基线降低最高达60.9%,并且在8周的治疗和额外的8周随访期间耐受性良好[10]。
MK-0616的两项三期临床试验已经在2023年启动,有望成功上市并因为优异的疗效、安全性和便利性成为重磅药物,根据行业预测其有潜力在销售高峰期达到年销售50亿美元。MK-0616的研发路径与临床结果为大环肽的研发提供了前行的方向。结合mRNA展示技术、基于结构的修饰提高稳定性和溶解度、使用渗透促进剂等,可使超越五原则的大环肽达到可行的口服生物利用度。
结语
多肽药物的市场规模近年来快速增长,环肽药物独特的构象为研发更有效、更安全、更便利的药物提供了极具潜力的解决方案,MK-0616等在研口服环肽药物的优异表现更是成为广受关注的焦点。因其不同小分子和线性肽和结构特征,其DMPK的研究思路和目标也有不同的要求。总结已上市和在研环肽药物的数据可发现超越5原则的特征,我们在理化性质、代谢稳定性、渗透性等研究中也开发和设计了针对性的实验方法和方案,建立从筛选到IND申报的研究策略,以终为始地为客户项目赋能。
目前在研的环肽管线已经有几百项进入到临床阶段,用于治疗包括肿瘤、感染性、血液系统疾病,相信这些研究将在不久的将来帮助更多患者重获健康和幸福生活。
作者:孙建平,马利萍,金晶
编辑:钱卉娟,富罗娜·克里木
设计:倪德伟,张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系。
参考
[1] You, Sophia, Glen McIntyre, and Toby Passioura. “The Coming of Age of Cyclic Peptide Drugs: An Update on Discovery Technologies.” Expert Opinion on Drug Discovery 19, no. 8 (August 2024): 961–73. http://doi.org/10.1080/17460441.2024.2367024.
[2] Brian Chia, C. S. “A Review on the Metabolism of 25 Peptide Drugs.” International Journal of Peptide Research and Therapeutics 27, no. 2 (June 2021): 1397–1418. http://doi.org/10.1007/s10989-021-10177-0.
[3] Khatri, Bhavesh, Venkateswara Rao Nuthakki, and Jayanta Chatterjee. “Strategies to Enhance Metabolic Stabilities.” Methods in Molecular Biology (Clifton, N.J.) 2001 (2019): 17–40. http://doi.org/10.1007/978-1-4939-9504-2_2.
[4] Mathiowetz, Alan M. “Design Principles for Intestinal Permeability of Cyclic Peptides.” In Cyclic Peptide Design, edited by Gilles Goetz, 1–15. New York, NY: Springer, 2019. http://doi.org/10.1007/978-1-4939-9504-2_1.
[5] Boehm, Markus, Kevin Beaumont, Rhys Jones, Amit S. Kalgutkar, Liying Zhang, Karen Atkinson, Guoyun Bai, et al. “Discovery of Potent and Orally Bioavailable Macrocyclic Peptide–Peptoid Hybrid CXCR7 Modulators.” Journal of Medicinal Chemistry 60, no. 23 (December 14, 2017): 9653–63. http://doi.org/10.1021/acs.jmedchem.7b01028.
[6] Poongavanam, Vasanthanathan, Bradley C. Doak, and Jan Kihlberg. “Opportunities and Guidelines for Discovery of Orally Absorbed Drugs in beyond Rule of 5 Space.” Current Opinion in Chemical Biology 44 (June 2018): 23–29. http://doi.org/10.1016/j.cbpa.2018.05.010.
[7] Buckton, Laura K., Marwa N. Rahimi, and Shelli R. McAlpine. “Cyclic Peptides as Drugs for Intracellular Targets: The Next Frontier in Peptide Therapeutic Development.” Chemistry – A European Journal 27, no. 5 (January 21, 2021): 1487–1513. http://doi.org/10.1002/chem.201905385.
[8] Appiah Kubi, George, Patrick G. Dougherty, and Dehua Pei. “Designing Cell-Permeable Macrocyclic Peptides.” In Cyclic Peptide Design, edited by Gilles Goetz, 2001:41–59. Methods in Molecular Biology. New York, NY: Springer New York, 2019. http://doi.org/10.1007/978-1-4939-9504-2_3.
[9] Johns, Douglas G., Louis-Charles Campeau, Puja Banka, An Bautmans, Tjerk Bueters, Elisabetta Bianchi, Danila Branca, et al. “Orally Bioavailable Macrocyclic Peptide That Inhibits Binding of PCSK9 to the Low Density Lipoprotein Receptor.” Circulation 148, no. 2 (July 11, 2023): 144–58. http://doi.org/10.1161/CIRCULATIONAHA.122.063372.
[10] Cm, Ballantyne, Banka P, Mendez G, et al. “Phase 2b Randomized Trial of the Oral PCSK9 Inhibitor MK-0616.” Journal of the American College of Cardiology 81, no. 16 (April 25, 2023). http://doi.org/10.1016/j.jacc.2023.02.018.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息














