新药研发不仅需要付出高昂的时间和资金成本,而且面临高达90%的失败率,其中,药物的理化性质是影响成功率的关键因素之一[1]。药物发现的筛选逻辑之一是根据化合物分子的结构特征深入探究其物理化学和生物化学性质,最终快速、准确地预测其药动学性质及毒性特征(图1)。极性作为重要的药物理化性质之一,与药物在靶部位的渗透性有强相关性,通常用极性表面积(polar surface area,PSA)来量化。暴露极性表面积(exposed polar surface area,EPSA),作为一种通过实验分析获得PSA的最新技术手段,因成功用于渗透性环肽的筛选而走进大众视野[2]。本文将具体介绍EPSA参与优化分子被动渗透性的研究与应用,以及基于超临界流体色谱法的检测EPSA的原理和方法。
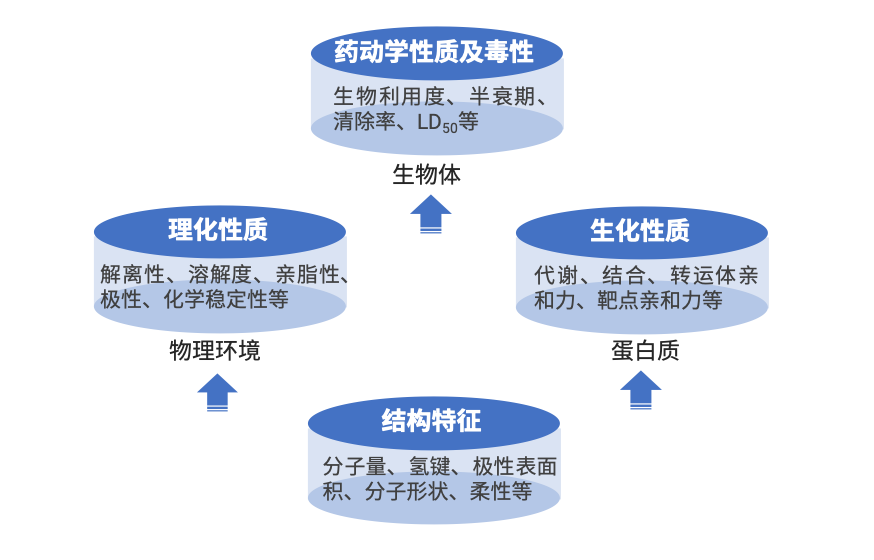
图1. 化合物的结构、性质与药动学及毒性的关系
PSA的概念及EPSA的简介
PSA指的是由极性原子(氧、氮等)以及其相连的氢原子形成的表面积之和(图2),其重要影响因素包括极性原子的种类和数量、分子构象及分子内部氢键系统等。在1992年,PSA就被用于预测药物在人体内ADME的特性。此外,在参与优化药物的人体肠道细胞和血脑屏障渗透性等方面,PSA也发挥了重要作用[3,4]。化合物PSA的获取一般基于计算机估算[5],包括动态PSA(dynamic PSA)、静态PSA(static PSA)、拓扑PSA(topological PSA,TPSA)(图3)。其中,TPSA方法因无需获得化合物复杂的3D构象便能快速计算出结果,成为许多研究人员的首选。
不同于既往获得PSA的计算机模拟方法,EPSA是一种最新提出的用于分析检测PSA的实验方法,指的是分子的暴露PSA,也有研究称其为实验PSA。目前,EPSA在高分子量的新型化学分子(如环肽、蛋白降解靶向嵌合体等)的应用受到了诸多关注。
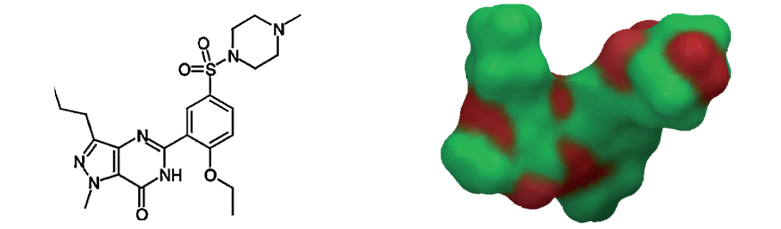
图2. 西地那非(左)对应范德华红色区域极性表面积(右)[5]

图3. EPSA的发展历程
EPSA的应用
EPSA最早被证实可以用于渗透性环肽(cyclic peptides)的筛选[2],渗透性环肽是属于“五规则”化学空间之外(beyond rule of five,bRo5)的药物,其他口服的bRo5药物还包括大环药物(macrocycles)、蛋白降解靶向嵌合体(proteolysis-targeting chimeras,PROTACs)、从头设计药物(de nove design)、非大环药物(not macrocycles compounds)、天然药物(natural products)等。

图4. FDA批准上市bRo5与Ro5药物占比分析[6]
随着获批上市的bRo5药物不断增多(图4)[6],研究发现,该类药物具有“分子变色龙”的特性,表现在非极性、类似于膜的环境中,其构象比在极性环境中更紧凑,极性表面积更低(图5)。“分子变色龙”的性质主要依赖于在非极性环境形成分子内氢键(intramolecular hydrogen bonding,IMHB),从而构象异变掩藏极性基团,最终提高自身的膜渗透性。
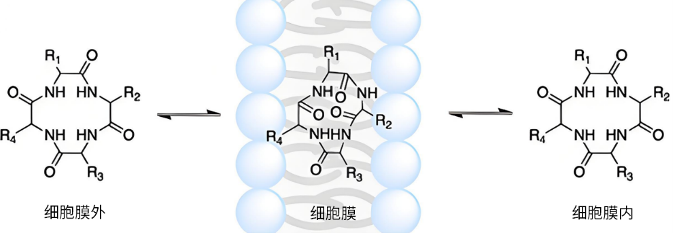
图5. 变色龙环肽分子被动扩散跨膜机制[7]
“分子变色龙”性质使得bRo5药物能与细胞内部一些大的、扁平的或凹槽状的靶标进行充分结合(图6),弥补了小分子Ro5(rule of five,Ro5)药物和一些生物制剂的不足[8,9]。但由于该类药物一般分子量大、极性强,导致其细胞渗透性差、口服生物利用度低。因此,迫切需要去探索如何设计改造bRo5药物的极性,从而增强其细胞渗透性和口服生物利用度。

图6. Ro5、bRo5及eRo5(extended rule of five)药物结合靶点的形状分布[2]
研究表明当分子量>700 Da,基于2D结构计算PSA的方法(如TPSA等)往往会高估分子极性(例如环孢素A,TPSA 280 Å2,EPSA 72 Å2)[10]。因此,需要使用EPSA纳入分子构象异变对极性的影响,识别化合物中的IMHB,从而检测bRo5药物真实的暴露极性。以下为EPSA的主要应用实例。
01 EPSA与体外细胞实验联合用于早期渗透性环肽的筛选
研究人员通过将EPSA与体外RRCK细胞实验联合,评估了814个环肽药物分子的渗透性,结果显示(图7),EPSA<80 Å2,环肽具有中等渗透性;EPSA>100 Å2,环肽没有显著的被动渗透性。该研究进一步指出,EPSA可作为发现渗透性环肽的过滤器,阈值为100 Å2[2]。
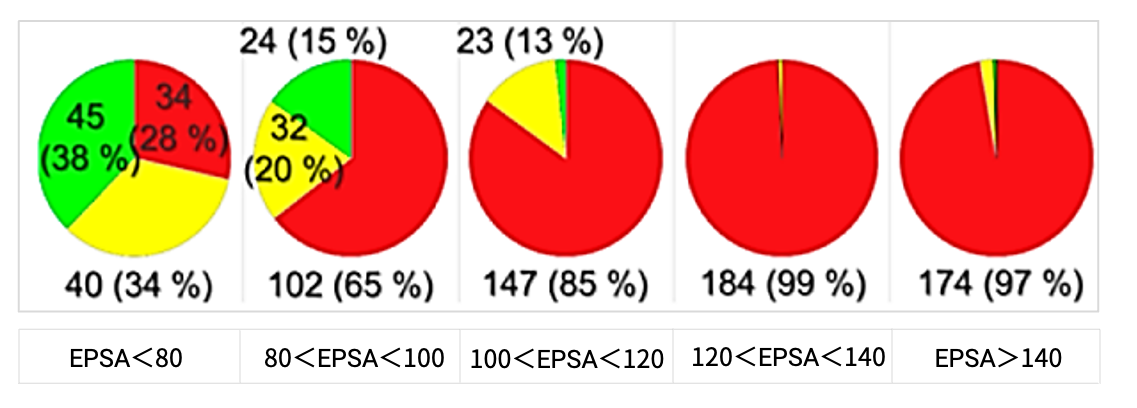
图7. EPSA和RRCK渗透率数据分析饼状图。(Papp<1x10-6 cm/s,不渗透(红色);1x10-6 cm/s<papp<5x10-6 cm/s,中等渗透性(黄色);Papp>5x10-6 cm/s,可渗透(绿色))
02 EPSA作为实验性“口服PROTACs规则”之一
实现良好的口服生物利用度对于不符合Lipinski类药五原则的PROTAC分子至关重要。研究发现,约1806个合成PROTAC分子在口服剂量高达30mg/kg的剂量研究中,其口服生物利用度≥25%的只占15%。为了研究关键的理化性质对PROTAC分子口服生物利用度的影响,研究人员报告了四种临床口服PROTACs(ARV-766、ARV-110、KT-474、ARV-471)在小鼠、大鼠和狗中的体内药代动力学特性,并与内部得出的数据集进行了比较(表1),最终总结出实验性“口服PROTACs规则”:eHDB ≤ 2、eHBA ≤ 16、ePSA ≤ 170、eRotB ≤ 13、MW ≤ 1000、chromLogD ≤ 7[10]。
calc./experiment | ARV-766 | ARV-110 | KT-474 | ARV-471 |
MW [Da] | 808 | 812 | 866 | 724 |
cLogP/LogD/chromLogD | 6.1/4.7/5.0 | 4.3/4.8/5.1 | 1.1/3.6/2.3 | 6.8/4.6/5.3 |
tPSA/ePSA [Å2] | 156/114 | 181/116 | 175/124 | 96/146 |
HBA/eHBA | 13/13 | 15/14 | 17/16 | 9/9 |
HBD/eHBD | 3/1 | 2/1 | 2/1 | 2/2 |
RotB/eRotB | 12/11 | 10/8 | 12/10 | 7/7 |
CL (m/r/d) [mL/min/kg] | 4.2/16/6.4 | 3.9/9.0/4.7 | 17/51/16 | 35/28/3.0 |
Vss (m/r/d) [L/kg] | 2.3/9.1/15 | 3.8/7.8/13 | 2.7/7.7/6.7 | 9.4/13/2.4 |
T1/2 (m/r/d) [h] | 6.8/7.4/31 | 13/9.3/32 | 4.0/2/6.8 | 6.2/15/11 |
F% (m/r/d) | 58/38/33 | 65/51/14 | 24/7/51 | 59/24/5 |
表1. 4种临床口服PROTACs的实验理化和药代动力学特性数据
其实,EPSA的应用范围并不局限于bRo5药物,还可以用于Ro5药物筛选。一项回顾性研究分析了1156种化合物的筛选过程[11],其中包括bRo5和Ro5药物。结果显示,EPSA作为筛选过程中的高通量过滤器,可以将筛选效率提高30%(图8A),且对于bRo5药物和Ro5药物的筛选准确度分别提高了20%和40%(图8B)。
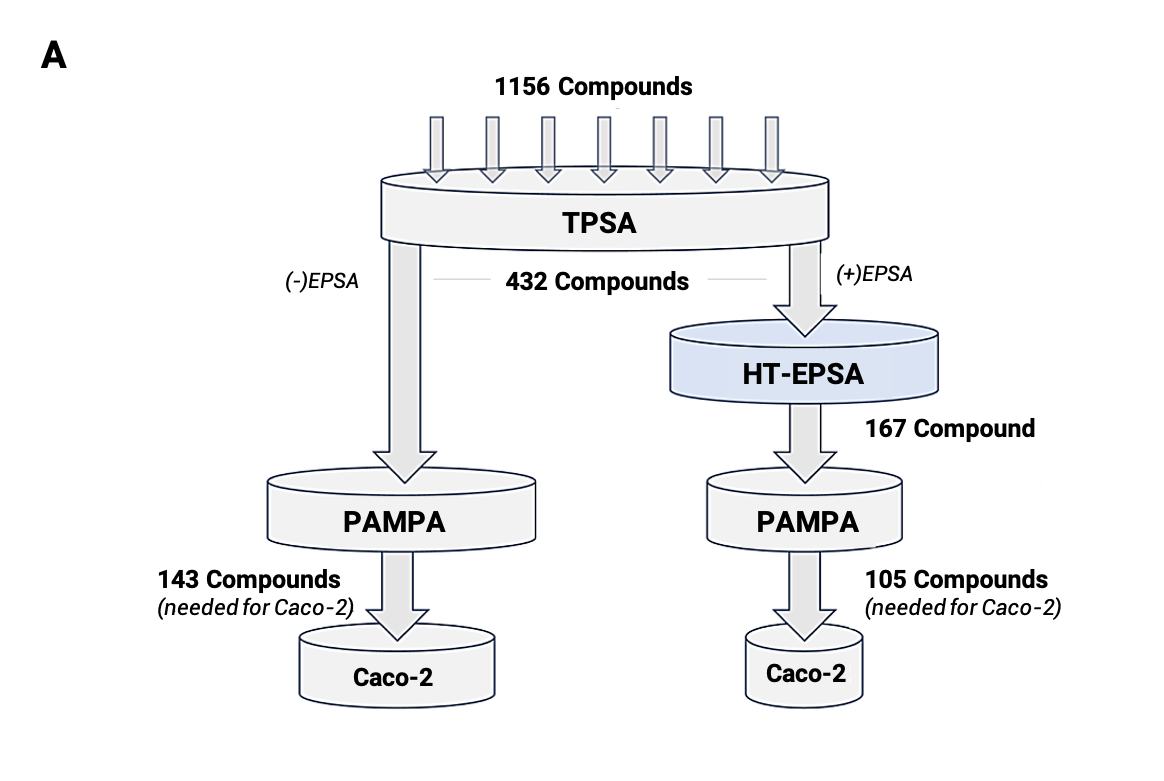
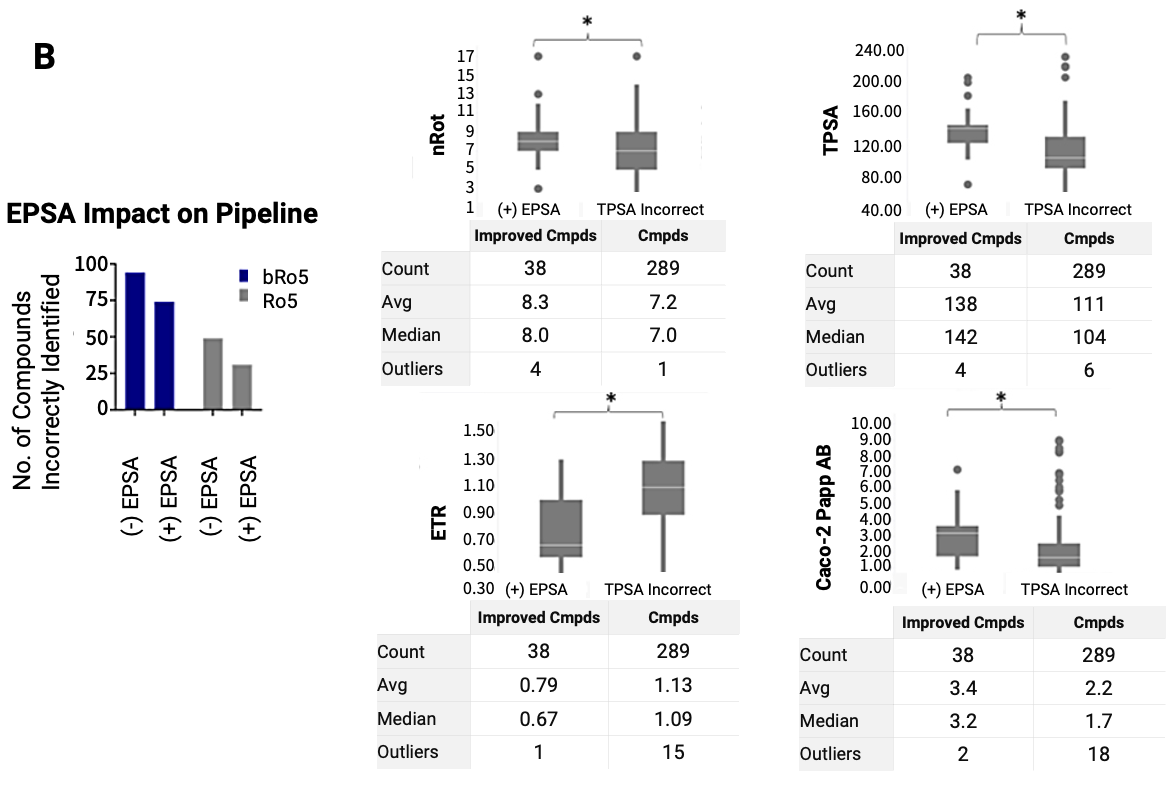
图8. 有(+)和没有(-)高通量EPSA的药物筛选回顾性漏斗分析。(A)为1156种化合物的回顾性漏斗分析,终点为TPSA、EPSA、PAMPA和Caco-2,EPSA校正了化合物筛选优先级。(B)为数据分析EPSA对药物筛选漏斗的影响,以及使用TPSA筛选错误的物理化学性质,用EPSA进行了校正。
星号(*)表示具有统计学意义(p<0.05)。
EPSA的检测原理及优点
EPSA基于超临界流体色谱技术(supercritical fluid chromatography, SFC)将色谱保留时间与分子极性的暴露相关联,从而检测分子极性大小。SFC技术是20世纪80年代迅速发展起来的一种以超临界流体作为其流动相,以固体吸附剂或键合在载体上的高聚物为固定相的色谱分析方法。对于某些纯物质来讲,气相和液相处于平衡时即为临界点,当高于临界温度和临界压力时,物质会以超临界流体形式存在。EPSA基于SFC技术可以与多种检测器串联进行定量和定性分析,以超临界流体为流动相,扩散系数更高且密度更低,可在较低柱压下获得较高的流速,从而分析柱效高,检测时间更短。
目前,EPSA所使用的检测方法已趋于成熟,可以精准量化变色龙分子的极性大小。在检测过程中,需特别注意以下几个条件:
检测环境不能破坏IMHB
“分子变色龙”性质主要依赖于在非极性环境中形成IMHB的相互作用,而IMHB与细胞渗透性增加相关,所以IMHB形成的可能性是药物设计的一个重要考虑因素[12]。EPSA的检测流动相使用超临界二氧化碳(scCO2),并添加改性剂甲醇形成低介电常数的分析环境,很好的模拟了脂质双分子层内部的疏水结构,有利于待测物构象异变并形成IMHB。检测固定相系二氧化硅键合S-缬氨酸和α-奈基乙胺,两者间以尿素相连(图9)[13]。固定相中含有大量的极性基团,其与待测物中暴露的极性基团发生的相互作用(氢键为主)越多,待测物的保留时间(tR)越长,极性就越大。
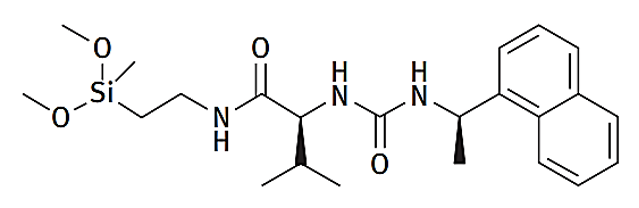
图9. Phenomenex Chirex 3014固定相结构
理想的参照化合物的选择
现有研究通过NMR等技术已经证实EPSA实验选择的对照化合物几乎不发生构象异变[14],故实验中对照化合物的EPSA值与其TPSA值相等,且与tR具有良好的线性关系。将待测物的tR代入对照化合物的TPSA值与tR拟合的线性方程中,即可计算得出待测化合物的EPSA值,检测范围为61-230 Å2。
目前,药明康德DMPK在使用UPCC串联质谱检测器和紫外检测器的基础上,已成功建立EPSA分析检测平台。通过Bland Altman分析对14种商业化合物的EPSA检测值与文献报道的EPSA值进行相关性验证后,结果显示该检测方法可靠(图10)。药明康德DMPK基于24分钟的洗脱方法,已顺利检测了涵盖Cyclic Peptides、PROTACs等多种bRo5与Ro5化合物的EPSA值,并且通过缩短色谱柱、优化洗脱梯度等手段,对EPSA的检测方法进行更新迭代,成功将单针检测时间缩短至6.5分钟,检测效率提高3倍且线性拟合更佳(图11),实现了EPSA的高通量、高质量检测。
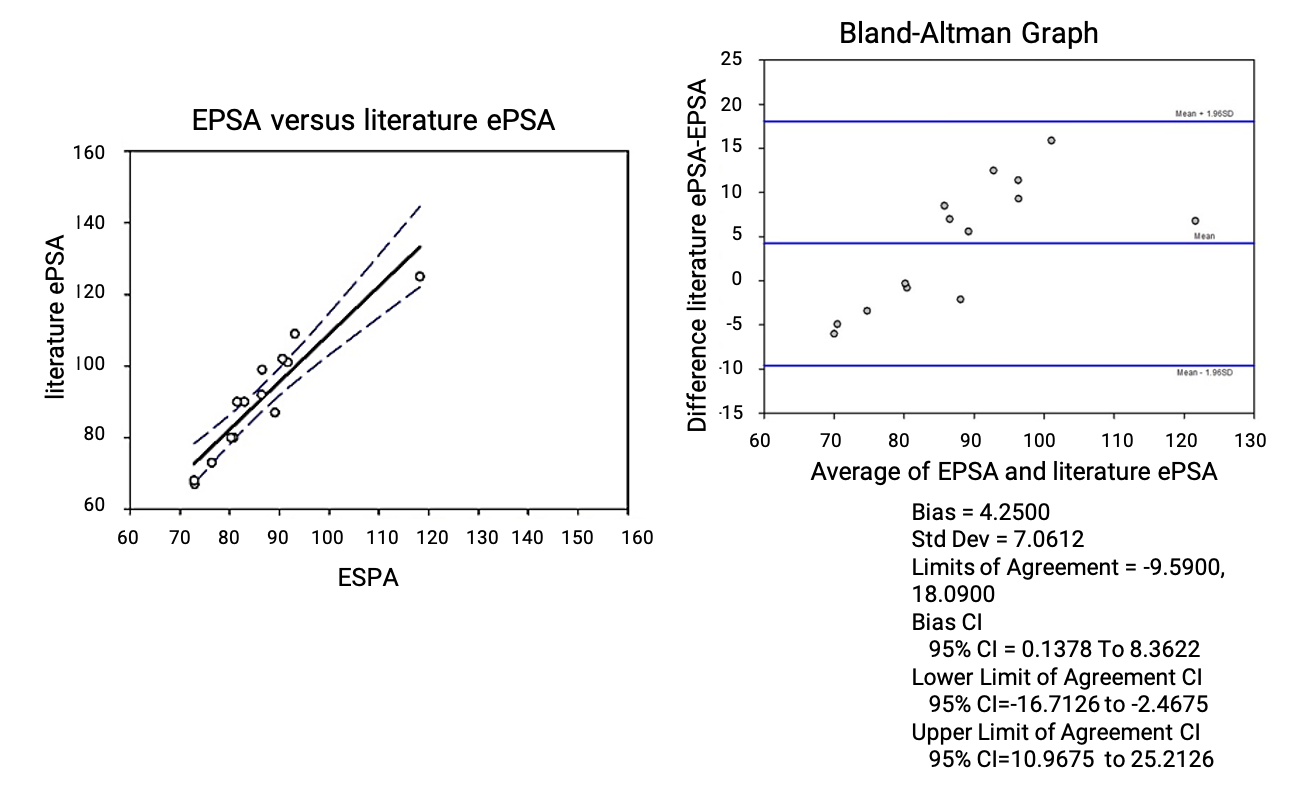
图10. 药明康德DMPK实验室检测14种商业化合物和文献报道的EPSA值相关性验证
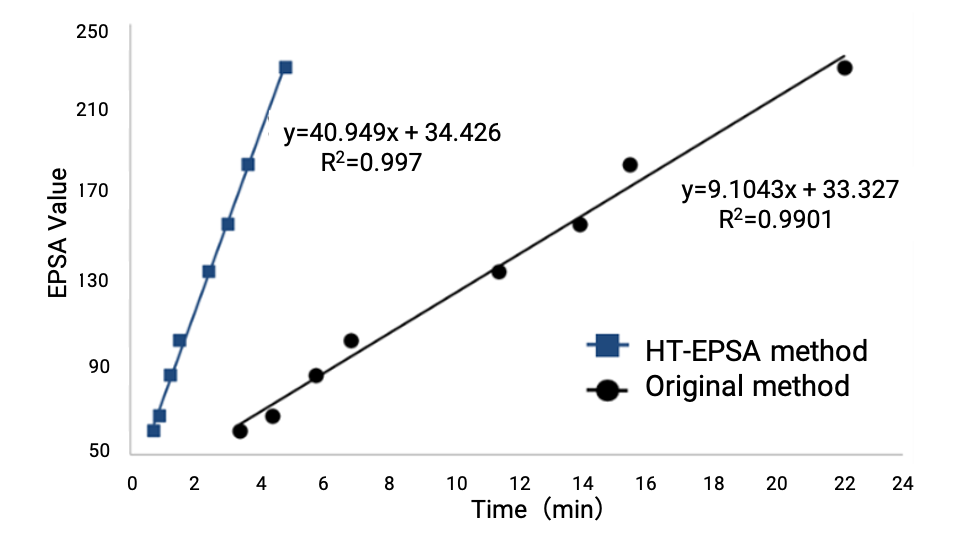
图11. 方法迭代后高通量EPSA和原方法线性拟合对比
结语
“分子变色龙”性质为攻克“不可成药”靶标的难题创造了有利机会。由于该性质基于化合物在生物学相关环境中所占据不同构象的属性,故需要应用基于3D结构研究的理化性质描述符。EPSA在描述分子暴露PSA时,纳入构象异变对分子极性的影响,其检测环境利于IMHB形成,从而能更精准量化变色龙分子的极性大小。进一步研究表明,EPSA与肠道细胞渗透性的相关性比TPSA强[11],在设计具有良好口服生物利用度的bRo5药物等方面,EPSA也发挥了重要的指导作用。目前药明康德DMPK已经成功建立EPSA检测方法并完成了更新迭代,理化性质研究业务涵盖新分子实体和小分子化合物,以实现覆盖面更广、检测效率更高、质量更好的一站式服务,助力推进新药研发进程。
作者:王如雪,何勇静,曲栗,刘丹丹,冯全利,汤城
编辑:富罗娜·克里木,钱卉娟
设计:倪德伟,张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系。
参考
[1] Sun D, Gao W, Hu H, et al. Why 90% of clinical drug development fails and how to improve it? [J]. Acta Pharm Sin B, 2022, 12(7):3049-3062.
[2] Goetz G H, Philippe L, Shapiro M J. EPSA: A Novel Supercritical Fluid Chromatography Technique Enabling the Design of Permeable Cyclic Peptides[J]. ACS Medicinal Chemistry Letters, 2014, 5(10):1167-1172.
[3] Papageorgiou C, Camenisch G, Borer X. Cell permeability as a parameter for lead generation in the protein Tyrosine kinase inhibition field[J]. Bio-organic & Medicinal Chemistry Letters, 2001, 11(12):1549-1552.
[4] Takle A K, Bamford M J, Davies S, et al. The identification of potent, selective and CNS penetrant furan-based inhibitors of B-Raf kinase[J]. Bio-organic & Medicinal Chemistry Letters, 2008, 18(15):4373-4376.
[5] Clark, David E. What has polar surface area ever done for drug discovery? [J]. Future Medicinal Chemistry, 2011, 3(4):469-484.
[6] Stegemann S, Moreton C, Svanbäck S, et al. Trends in oral small-molecule drug discovery and product development based on product launches before and after the Rule of Five[J]. Drug Discovery Today, 2023, 28(2): 103344.
[7] Buckton L K, Rahimi M N, McAlpine S R. Cyclic peptides as drugs for intracellular targets: the next frontier in peptide therapeutic development[J]. Chemistry–A European Journal, 2021, 27(5): 1487-1513.
[8] Zheng, Jie, Doak, et al. How Beyond Rule of 5 Drugs and Clinical Candidates Bind to Their Targets[J]. Journal of Medicinal Chemistry, 2016, 59, 2312-2327.
[9] Villar E A, Beglov D, Chennamadhavuni S, et al. How proteins bind macrocycles[J]. Nature Chemical Biology, 2014, 10(9).
[10] Schade M, Scott J S, Hayhow T G, et al. Structural and Physicochemical Features of Oral PROTACs[J]. Journal of Medicinal Chemistry, 2024(15):67.
[11] Yue ting Wang, Edward Price, Mei Feng, et al. High-Throughput SFC-MS/MS Method to Measure EPSA and Predict Human Permeability[J]. Journal of Medicinal Chemistry, 2024, 67, 13765-13777.
[12] Caron G, Kihlberg J, Goetz G H, et al. Steering New Drug Discovery Campaigns: Permeability, Solubility, and Physicochemical Properties in the bRo5 Chemical Space[J]. ACS Medicinal Chemistry Letters, 2021, 12(1):13-23.
[13] Marziale A .6. SFC as a novel approach to assess polarity and identify intramolecular hydrogen bonding: Volume 1[M]. 2018.
[14] Goetz G H, Farrell W, Shalaeva M, et al. High throughput method for the indirect detection of intramolecular hydrogen bonding[J]. Journal of Medicinal Chemistry, 2014, 57(7):2920-2929.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息














