近年来,由于生物技术的快速发展,利用mRNA作为治疗药物生产人体中几乎所有的功能性蛋白质成为可能[1]。在预防和治疗多种疾病领域,基于mRNA的疫苗/治疗性药物拥有广阔的发展前景,目前正在进行的mRNA疫苗/治疗性药物研究管线数量也在逐步增加。为了更好地了解mRNA疫苗/治疗性药物的药效和安全性,特别是药代动力学(PK)、毒代动力学(TK)、组织分布和药效学(PD)的研究,准确地定量系统循环和不同组织中的mRNA药物水平变得尤为重要。
RT-qPCR平台被广泛认为是定量mRNA的黄金标准,最近,Branched-DNA(bDNA)平台成为热门,为RT-qPCR平台提供了独特补充。本文将以Sprague Dawley大鼠血浆中的模拟LNP-mRNA治疗性药物为例,通过比较其在RT-qPCR和bDNA两个平台上的生物分析方法验证性能,为计划进行治疗性mRNA生物分析的研究人员提供实践经验。
RT-qPCR和bDNA方法介绍
PCR是一种基于酶扩增的检测方法,广泛应用于分子生物学研究和诊断。PCR可通过短互补引物探针,在多个热循环中(通常为40-45个循环)扩增逆转录自mRNA的cDNA模板。SYBR green染料(插入双链DNA产物)或TaqMan荧光探针(在创建子拷贝时切割并释放荧光报告基团)是检测和定量扩增DNA产物的两个主要系统。基于PCR的方法已广泛用于mRNA疫苗/药物的PK和生物分布研究,包括对癌症疫苗中编码抗原的mRNA的定量、对人血浆和特定组织中COVID-19疫苗mRNA(mRNA-1273或BNT162b2)的定量。为了评价mRNA-1273和BNT162b2疫苗mRNA穿过血乳腺屏障和血胎盘屏障的能力,可通过qPCR方法对乳汁和胎盘外植体中的mRNA浓度进行定量。
多年来,学术实验室一直使用bDNA对长链核酸进行定量,目前已广泛用于HIV、HCV和HBV感染的病毒载量定量。该试验利用定制的捕获、阻断和Z延伸探针与靶mRNA序列的大片段杂交结合,扩增探针能特异性识别双Z延伸探针,并使用检测试剂对信号进行扩增。bDNA检测试剂盒可用于定制板或基于微珠的检测形式。该技术被用于评价大鼠中COVID-19 mRNA疫苗(mRNA-1647)的组织分布和小鼠中含有编码血凝素的mRNA的流感疫苗的组织分布。两种方法的原理如图1所示。
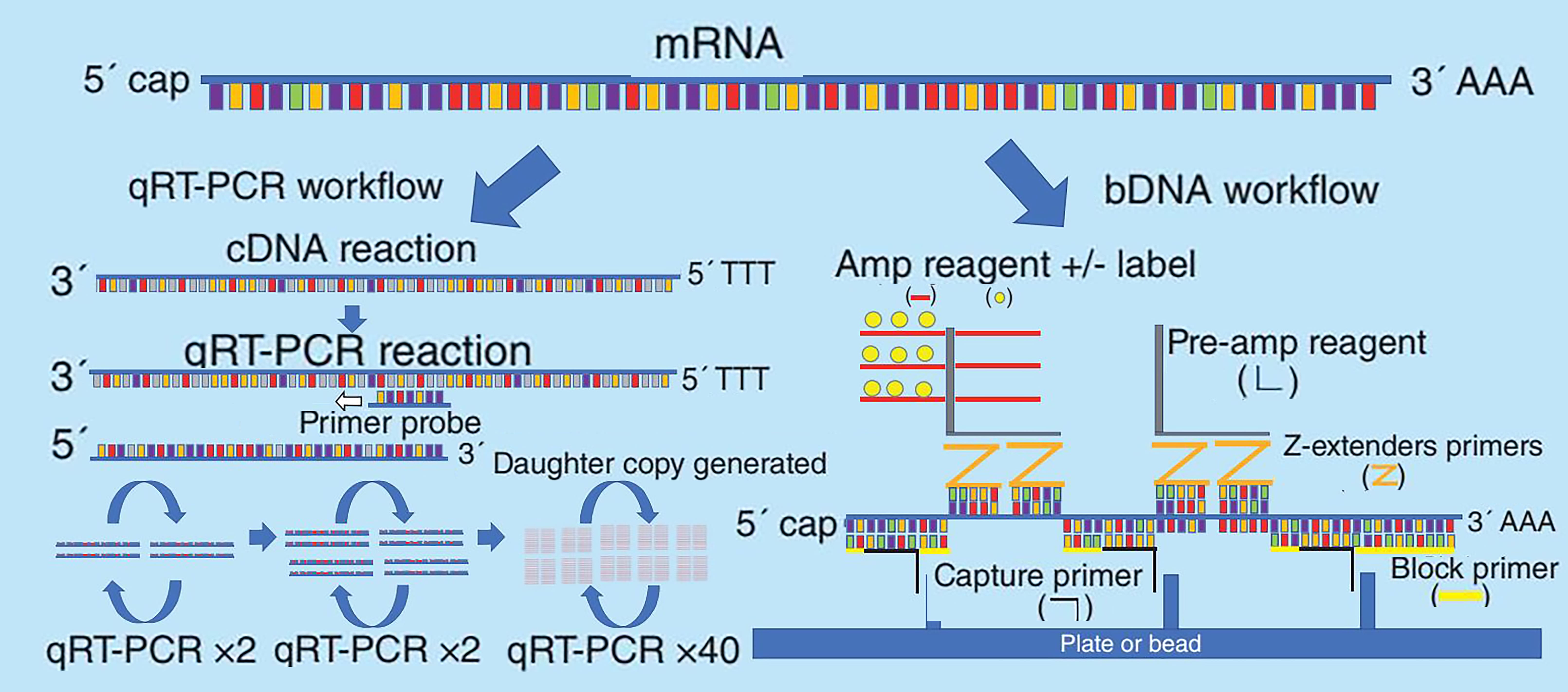
图1. RT-qPCR和bDNA方法原理示意图[2]
RT-qPCR和bDNA定量方法性能和验证参数比较
bDNA和RT-qPCR平台对血浆中LNP-mRNA的定量有方法学性能的差异。由于血浆中内源性mRNA含量很低,RT-qPCR检测样品预处理使用直接裂解法,再进行逆转录和qPCR步骤。bDNA检测使用的是基于测量内源性mRNA曾用方法的修改。具体两种方法的流程如图2所示。
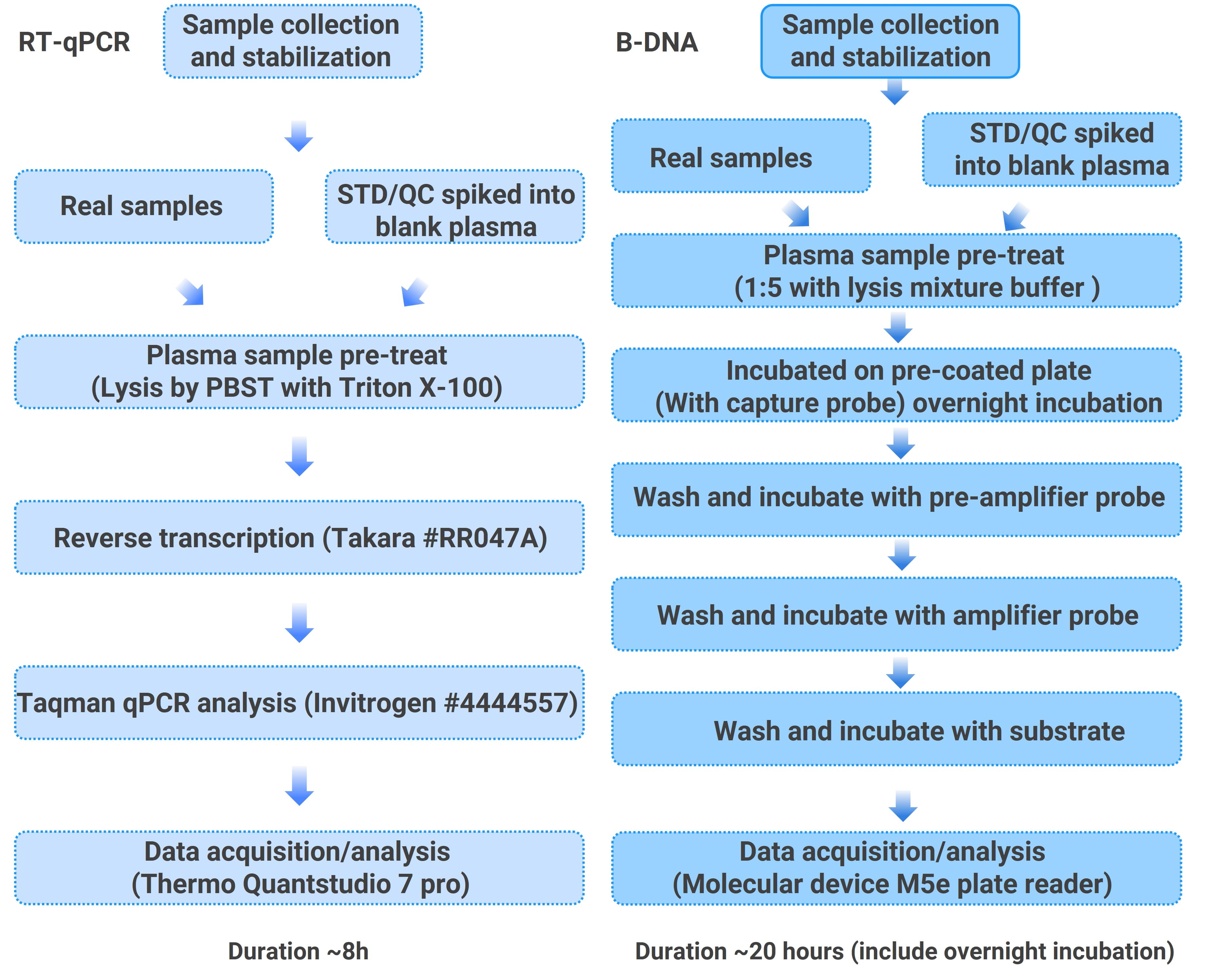
图2. RT-qPCR方法和bDNA方法对血浆中的LNP-mRNA(EGFP mRNA)进行定量分析实验流程图
本次实验使用商品化的LNP-mRNA(编码EGFP)进行测试,用于RT-qPCR的引物和探针由Primer-blast软件设计。正向引物序列为GAGCGCACCATCTTCTTCAA,反向引物序列为TGATGCCGTTCTTCTGCTTG。TaqMan探针序列为用5'Fam-3'Tamra标记的ACAAGACCCGCGCCGAGGTG。对于bDNA检测,使用商品化的QuantiGeneTM试剂盒和B-DNA EFGP探针组,孵育温度校准使用QuantiGene™温度验证试剂盒。经过评估各方法的灵敏度、检测范围、批内和批间准确度和精密度、抗内源性mRNA干扰能力、选择性和稳定性[3,4]。比较了以下各参数性能。
灵敏度参数
RT-qPCR方法的定量下限(LLOQ)为1pg/mL。bDNA方法的LLOQ为2pg/mL。从定量范围看,RT-qPCR有较宽的线性范围,从1pg/mL到1ug/mL(一百万倍),而相较基于化学发光(Chemiluminescence)的原理,bDNA方法的定量范围要窄很多,从2pg/mL到250pg/mL,并且采用逻辑回归(Logistic Regression)的拟合方式。两种方法的标准曲线如图3所示。
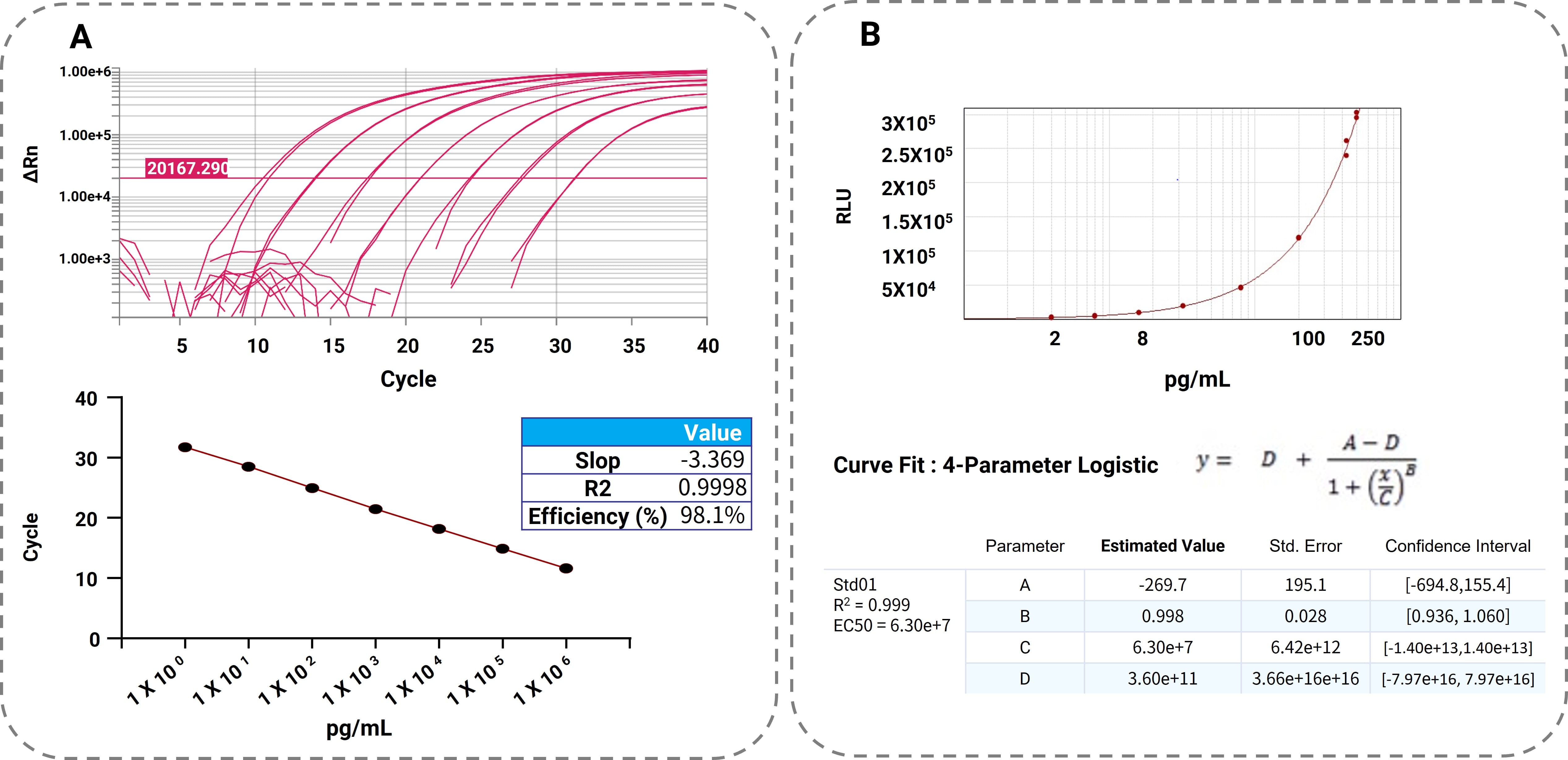
图3. 图A为RT-qPCR扩增和定量标准曲线示意图。左图X轴为qPCR循环数;Y轴为ΔRn值。曲线表示从STD01到STD07的标准样品(对应浓度如右图所示);右图是RT-qPCR定量标准曲线。X轴从右到左表示STD01-STD07样品浓度(pg/mL);Y轴为qPCR循环ct值。
图B为bDNA定量标准曲线,X轴从左到右代表STD01-STD08样品浓度(pg/mL),Y轴为相对光单位(RLU)值。
批内/批间准确度和精密度
如图4所示,评估RT-qPCR和bDNA方法时,每个run都有1组标准样品(STD)和3组5个不同浓度的质控(QC)样品。其中RT-qPCR方法标准曲线样品浓度设置为1x106、1x105、1x104、1x103、1x102、1x101、1x100pg/mL;质控样品浓度设置为1x106、5x105、5x103、5x101、1x100pg/mL。bDNA方法标准曲线样品浓度设置为250、212.5、100、40、16、8、4、2pg/mL;质控样品浓度设置为250、200、30、6、2pg/mL。
从以上评估可以看出,bDNA方法有更好的精密度和准确度。一般bDNA方法的%CV和%Bias小于10%。而RT-qPCR方法的%CV和%Bias要高得多,尤其是在较低浓度范围。bDNA方法的质控样品(ULOQ、HQC、MQC、LQC、LLOQ)总误差(%CV加上|%Bias|)分别为2.8%、4.4%、6.5%、6.7%和7.1%。相比之下RT-qPCR方法的质控样品总误差分别为19.6%、22.5%、19.5%、30.2%和35.6%。
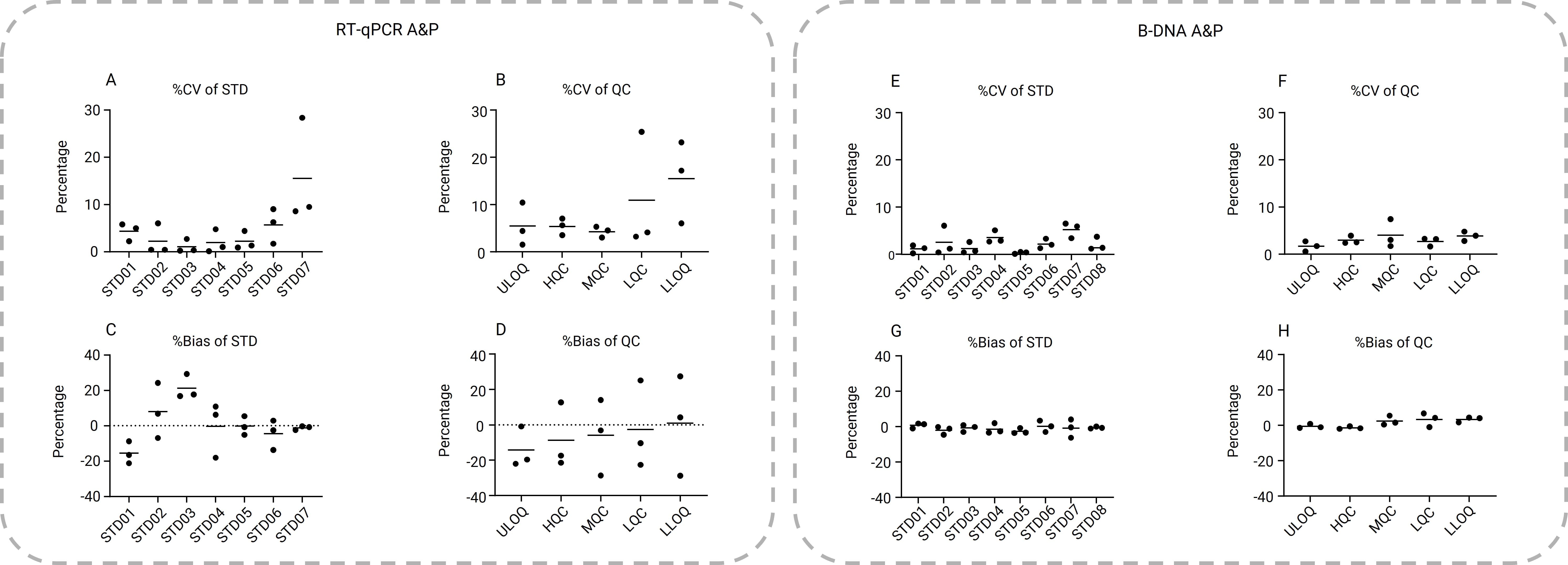
图4. A-D为RT-qPCR方法三个分析批标准曲线样品/质控样品的精密度和准确度的%CV和%Bias,3个分析批的平均值用横线表示。E-H为bDNA方法三个分析批标准曲线样品/质控样品的精密度和准确度的%CV和%Bias,3个分析批的平均值用横线表示。
抗内源性mRNA干扰能力
通过评估实验发现,RT-qPCR方法可以耐受更高水平的内源性mRNA干扰。该实验将不同浓度的SD大鼠肝组织纯化的mRNA,通过人为方式加入bDNA或RT-qPCR反应体系中。由干扰情况分析可知,RT-qPCR方法的HQC/LQC样品可以耐受高达25ug/反应的内源性mRNA浓度。而bDNA方法的耐受性较差,1ug/反应mRNA已经可以抑制信号,如图5所示。
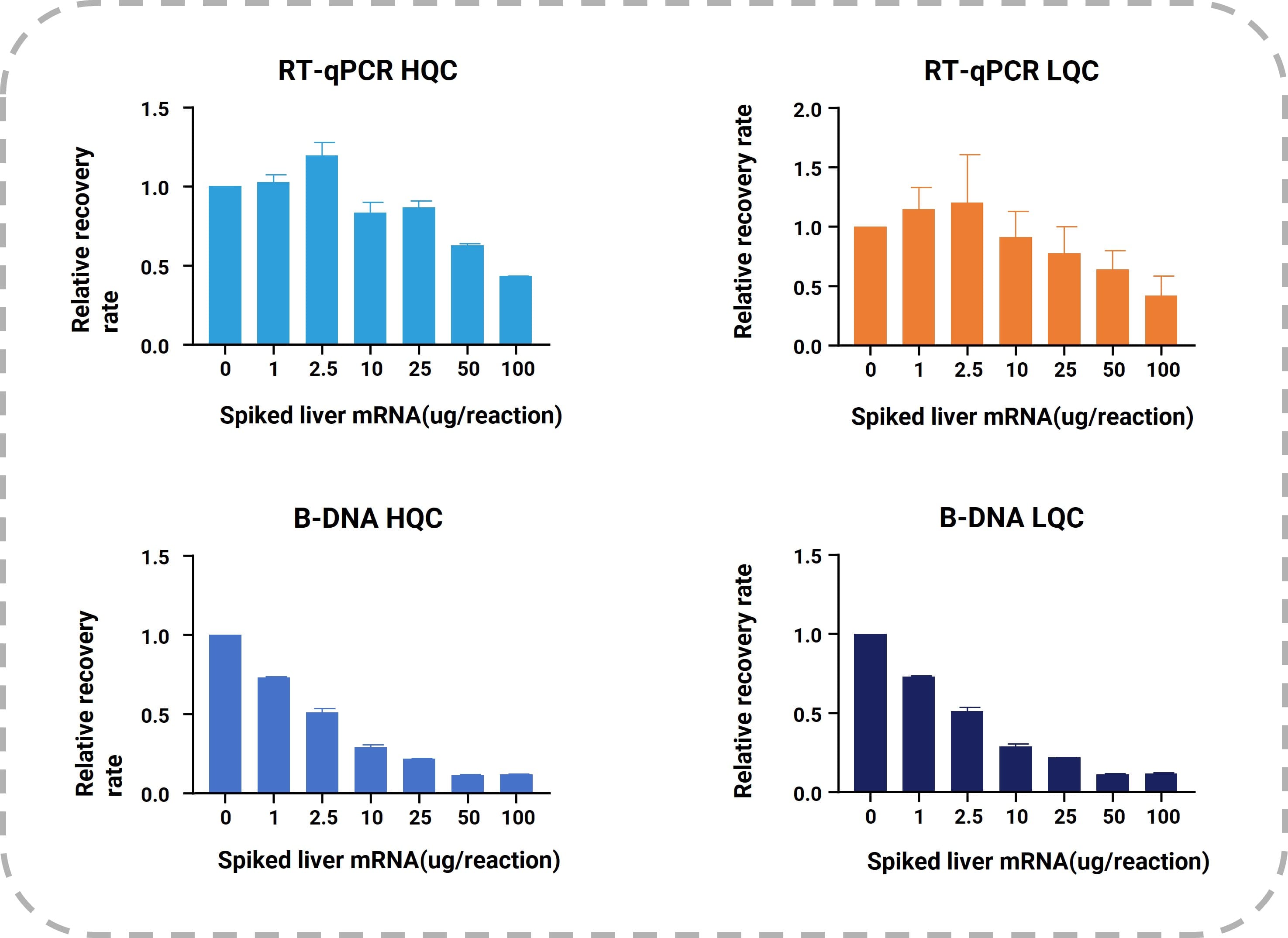
图5. 内源性mRNA对于RT-qPCR和bDNA方法高浓度QC和低浓度QC样品的信号抑制水平。X轴表示加标内源性mRNA/反应的量,Y轴表示回收率。未加入内源性mRNA样品视为1(100%)。
选择性参数
两种方法在不同浓度(ULOQ、HQC、LLOQ)的雌雄SD大鼠共10个不同个体血浆中,均表现出良好的选择性。RT-qPCR方法中,100%的ULOQ/HQC样品及94%的LLOQ样品通过了选择性评价。bDNA方法中,所有样品均通过了选择性评价。
稳定性参数
两种方法在不同条件下对测试样品均显示出良好的稳定性,包括五次冻融循环、室温孵育6小时和4℃孵育24小时。稳定性样品与基线样品之间的|%Bias|均小于20%(RT-qPCR为30%)。
小结
综上所述,bDNA和RT-qPCR平台对血浆中LNP-mRNA定量上方法学性能比较结果如下:
通过优化分析方法,bDNA方法可以实现与RT-qPCR方法(1pg/mL)相当的定量下限(2pg/mL),但测定范围较窄(bDNA为2-250pg/mL,而RT-qPCR的线性范围为1x106)。
与RT-qPCR方法相比,bDNA方法在准确度和精密度评估方面具有优势,可以满足LBA平台的法规接受标准。
bDNA方法对内源性mRNA干扰的耐受性较低。相比血浆来说,组织样本的内源性mRNA较多,不同组织差异较大,因此这种方法对于组织样本生物分析的考量点更多。
两种方法具有相当的选择性和稳定性性能。
引物/探针设计和优化对两种方法都至关重要,正确的设计可以显著提高检测性能。
结语
理论上,mRNA疫苗/治疗药物可以通过核糖体表达系统翻译成任何蛋白/肽段。相对于基于DNA的基因治疗药物,mRNA药物因为无需进入细胞核发挥疗效,其转染效率相对更高且毒性更低,更重要的是其没有潜在插入诱变或感染的风险,无需担心因非靶DNA序列被修改而造成的脱靶毒性。并且相对于传统蛋白疗法,mRNA药物可以持续翻译成编码的蛋白质,具备更好的药效和潜力。通常mRNA药物由于载体、表达蛋白、免疫原性等特性,其ADME有效性以及安全性的研究内容相对更加复杂,涉及到的生物分析平台和策略也更多。
药明康德DMPK具备丰富的临床前生物分析经验,目前已承接几十个mRNA疫苗/药物的生物分析项目,积累了丰富的分析经验,可以帮助客户快速完成临床前生物分析方法的建立和验证,满足药代动力学的FDA/NMPA/TGA的IND申报要求。目前药明康德DMPK建立的mRNA药物整合性生物分析平台,可以帮助mRNA药物开发者在不同的研究阶段更加高效/准确地评估药物体内外的ADME特征和组织分布,更好地理解其药效与安全性之间的关系,为后续的安全性评价和临床研究打下坚实的基础。
作者:周毛天,颜欢,宋苗苗,邢丽丽
编辑:富罗娜·克里木,钱卉娟
设计:倪德伟,张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系
参考
[1] Qin, Shugang, etal."mRNA-based therapeutics: powerful and versatile tools to combat diseases." Signal transduction and targeted therapy 7.1(2022): 166.
[2] Henderson, Neil, and Amanda Wilson. "Measurement of mRNA therapeutics: method development and validation challenges." Bioanalysis 11.21(2019): 2003-2010.
[3] Wissel, Mark, et al. "Recommendations on qPCR/ddPCR assay validation by GCC." Bioanalysis 14.12(2022): 853-863.
[4] Bioanalytical Method Validation Guidance for Industry, FDA 2018.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息