药物代谢通常是指药物在体内I相和II相代谢酶的作用下发生的生物转变,产生的代谢物极性增加、水溶性提高、药理活性减弱或完全失活,是实现药物解毒的过程。然而,某些情况下,药物代谢也是产生毒性的过程,经过代谢活化产生一些具有亲电性的反应性代谢物(例如环氧、醌、碳正离子和醌亚胺等),代谢物的亲电性使得它们能够与体内的生物大分子(包括核酸和蛋白质等)发生共价结合,破坏或改变大分子物质正常生理功能,从而引起细胞损伤、肝毒性、免疫毒性反应以及癌症等。由反应性代谢物引起的药物代谢安全性问题在一定程度上影响着药物研发的成功或失败。

图1. 外源性化合物的代谢途径[1]
近年来,药物代谢安全性问题受到越来越多的关注,代谢活化产生反应性代谢物是研究药物安全性非常重要的切入点。本文主要从以下几个方面进行阐述:
与反应性代谢物相关的药物代谢安全性问题;
哪些类型的化合物容易产生反应性代谢物;
反应性代谢物常用的分析检测方法;
反应性代谢物筛查在药物研发过程中的应用。
希望本篇文章能够为致力于提高药物安全性的研发人员提供参考。
反应性代谢物引发的药物安全性问题
最初,人们对一些化学反应相对惰性的物质表现出生物毒性感到困惑,直到19世纪50年代以后这个谜题才逐渐解开。Elizabeth和James Miller [2]于1947年报道了外源性物质对蛋白质的共价修饰。他们在大鼠给药甲氨基偶氮苯染料后的肝组织中,观察到黄色色素不可逆地与肝脏蛋白共价结合。随后,又有研究者对DNA作为遗传物质的结构和功能进行了表征,并发现了动物体内DNA与致癌物的结合物[3]。由此,揭开了外源性物质在生物体内代谢活化与大分子物质共价结合的面纱。代谢活化产生反应性代谢物引起共价结合的发现为药物毒性的探索开拓了新的空间。
对乙酰氨基酚的毒性研究是比较经典的案例[4, 5](图2)。对乙酰氨基酚主要通过葡萄糖醛酸和硫酸结合消除,次要代谢途径是在CYP450酶作用下氧化生成N-乙酰基-对苯醌亚胺(NAPQI,反应性代谢物),NAPQI会迅速消耗谷胱甘肽(GSH),当体内GSH浓度较低时,就会共价结合蛋白质上的游离半胱氨酸残基(含巯基官能团)。目前,广泛认为,代谢活化产生NAPQI与蛋白质发生共价结合是对乙酰氨基酚导致药源性肝损伤的主要原因。研究表明,许多药物产生生物毒性诸如曲格列酮(Troglitazone)引起肝衰竭、氯氮平(Clozapine)引起粒细胞缺乏症和奈法唑酮(Nefazodone)引起肝毒性等,均与其在体内代谢产生反应性代谢物进而与生物大分子共价结合有关[6-8]。

图2. 对乙酰氨基酚代谢活化过程[4, 5]
近些年,由药物毒性引起的药物召回案例不在少数(表1)。在一项研究中,对200个在售药物及68个被市场召回或收到黑箱警告药物调研发现[7],至少有一半的母体药物分子介导的毒性与反应性代谢物密切相关。反应性代谢物作为引起药物代谢安全性问题的直接信号之一,是药物结构设计过程中不得不考虑的影响因素。应当尽早筛查药物代谢可能产生的反应性代谢物,以便修饰或筛除有问题的化合物。通过合理的结构设计,将药物产生反应性代谢物的倾向性降到最低。
表1. 从市场召回药物及反应性代谢物分析[7]
药物名称 | 结构式 | 适应症 | 撤市原因 | 反应性代谢物产生(Yes/No) |
Troglitazone |
| Antidepressant | Hepatotoxicity | Yes |
Amineptine |
| Antidepressant | Hepatotoxicity | Yes |
Bromfenac |
| NSAID | Hepatotoxicity | Yes |
Ibufenac |
| NSAID | Hepatotoxicity | Yes |
Pirprofen |
| NSAID | Hepatotoxicity | Yes |
Tienilic acid |
| Diuretic | Hepatotoxicity | Yes |
Aminopyrine |
| Analgesic | Blood dyscrasias | Yes |
Tolcapone |
| Anti-parkinson | Hepatotoxicity | Yes |
常见药物警戒结构
近年来报道了许多可以产生反应性代谢物的药物。从代谢反应的角度来看,药物的分子结构在很大程度上决定了它们是否容易被代谢活化而产生毒性。除了一些药物本身具有的不同强度亲电性基团以外(例如环氧、醛基和α, β-不饱和酮或酯等,可参考前期文章“共价抑制剂药物研发中的DMPK考量”评估药物分子中亲电官能团固有的反应性),表2总结出了部分常见的可能通过代谢活化导致毒性的药物警戒结构(例如活泼的苯环、噻吩环、呋喃环等)以及其可能的反应性代谢物。对于含有警戒结构的药物分子,需关注其潜在的代谢活化能力。
表2. 药物警戒结构及可能的反应性代谢物[9]
警戒结构 | 可能的反应性代谢物 | 警戒结构 | 可能的反应性代谢物 |
Aromatic amines | Quinone-imine or nitroso metabolite | 3-Methyleneindoles | Imine-methide |
Hydrazine, hydrazides | Diazene or diazonium ion | Furans | α, β-Unsaturated dicarbonyl |
Nitroarenes | Nitroso | Thiophenes | α, β-Unsaturated dicarbonyl |
Fused azaheterocycles | Nitrenium ion | Thiazoles | Thioamide, glyoxal |
Benzylamines | Nitroso, oxime | Thiazolidinediones | Isocyanate, S-oxide |
Foramides | Isocyanate | Arenes, bromoarenes | Arene oxide |
Sulfonylureas | Isocyanate | Alkynes | Ketenes, oxirene |
Thioureas | S-Oxides, isocyanate | α, β-Unsaturatedcarbonyl | Intrinsic electrophilicity |
Hydroquinones | p-benzoquinone | Aliphatic amines | Iminium ion |
o- or p-Alkylphenols | o or p-Quinone methide | Alkylhalides | Acylhalides |
Methylenedioxyphenyl | o-quinone | etc. | etc. |
需要注意的是,对药物警戒结构的认识有助于判断可能发生代谢活化的药物分子,但这并不是绝对的,已经上市的药物分子中存在一些化合物,它们的分子结构中含有警戒结构而实际应用过程并未产生毒性,警戒结构是否参与代谢以及代谢的程度可能会受到分子中其他基团的影响。通常需要借助相应分析检测技术,评估药物分子的代谢活化潜能。
反应性代谢物检测方法和技术平台
外源性物质代谢活化产生反应性代谢物,其代谢活化的过程主要是由I相代谢酶(例如CYP450酶)介导,因此,体外孵育实验常常在肝微粒体体系中进行。如果药物的代谢活化涉及到II相代谢酶或者混合的I相/II相代谢酶,那么考虑选用肝S9或者肝细胞体系等进行实验。反应性代谢物能够与细胞中的大分子物质(例如蛋白质)发生共价结合,它的半衰期通常较短,在体外和体内实验中难以直接检测。目前,对反应性代谢物的检测方法主要分为两种:
01 采用小分子探针进行捕获
文献报道过的小分子捕获探针包括谷胱甘肽(GSH)、半胱氨酸、N-乙酰半胱氨酸、氨基脲、甲氧胺、氰基阴离子等。其中,谷胱甘肽作为化学反应性代谢物的天然诱捕剂,能够捕获大多数的反应性代谢物(包括环氧化合物、芳烃氧化物、烷基卤化物、迈克尔受体和醌类物质等),广泛应用于早期药物发现和筛选阶段反应性代谢物体外筛查实验。值得注意的是,并非所有的反应性代谢物都能够被GSH捕获,这取决于代谢物的性质,如“硬”的代谢物和“软”的代谢物。改变或选择额外的捕获试剂,可以有目的的考察反应性代谢物并对实验数据进行补充和丰富,例如选用氰化物捕获亚胺离子或者选用甲氧胺捕获活性醛基物质等反应性中间体。
02 直接检测-生物大分子共价结合物
这种方法大多需要对母体药物进行放射性同位素标记,用标记后的药物与体外肝微粒蛋白、新鲜分离的肝细胞或小鼠肝匀浆等共同孵育一定时间,或者是动物体内给药以后制备肝组织匀浆液等,通过检测沉淀物中蛋白共价结合物的放射性强度,评价药物共价结合的水平以及代谢活化的潜能。与生物大分子共价结合实验被认为是定量评估反应性代谢物的金标准。
药明康德DMPK拥有成熟的反应性代谢物检测和鉴定平台,可以实现对多种实验体系的代谢物检测鉴定,包括采用不同类型小分子探针对代谢物的捕获实验和基于放射性同位素标记的药物与大分子物质共价结合实验等。平台具有先进的仪器设备,涵盖多台超高效液相色谱系统、PDA检测器、飞行时间质谱仪、静电场轨道阱质谱仪以及液体闪烁计数仪等,借助高分辨质谱技术、放射性检测技术、数据采集和后处理技术,多维度挖掘代谢物信息,实现各种不同类型生物基质样品中多重反应性代谢物组分的检测和鉴定。
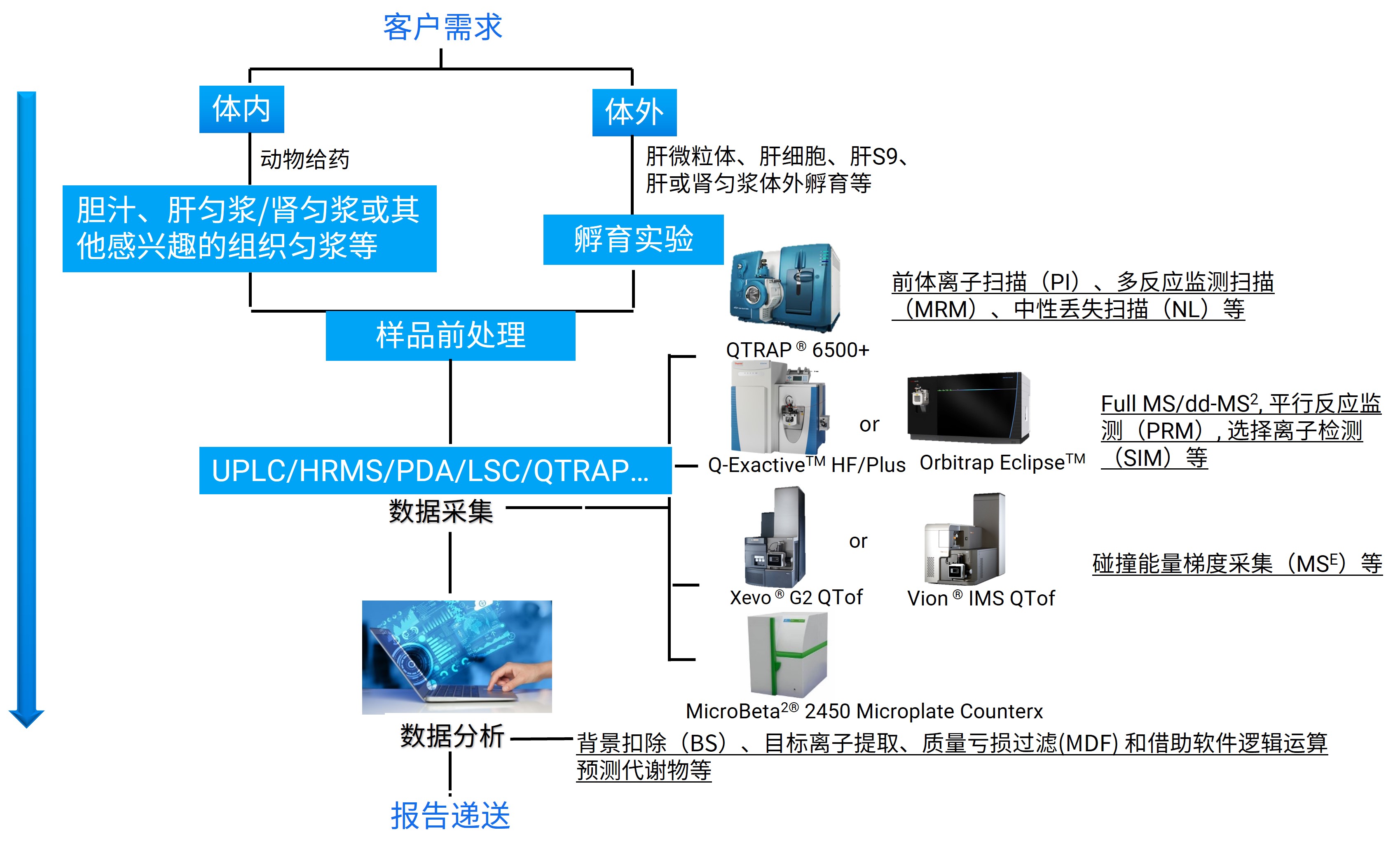
图3. 反应性代谢物检测鉴定工作流程图
如下是药明康德DMPK技术团队基于对氯氮平的体外反应性代谢物筛查研究进行的案例分析和相关技术验证:
氯氮平(clozapine)是一种非典型抗精神病药物,具有较好的镇静催眠作用。据文献报道[10],氯氮平在体外代谢酶的作用下发生代谢活化,产生反应性亚胺离子,进而与GSH或蛋白质发生共价结合(图4),推测反应性亚胺离子共价结合靶蛋白与氯氮平在临床治疗中引起粒细胞缺乏症和肝毒性等不良反应密切相关。在接受氯氮平治疗患者的中性粒细胞中可以检测到被共价修饰的蛋白质,进一步证实了上面的推测。
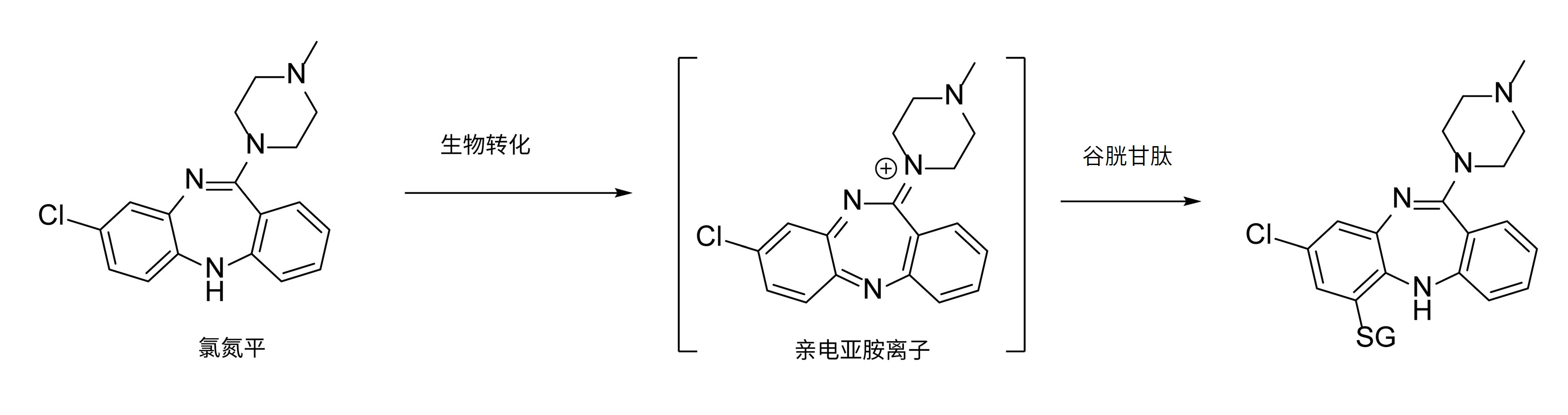
图4. 氯氮平代谢活化途径[10]
本案例中,我们以氯氮平为受试物,谷胱甘肽作为捕获探针,人肝微粒体作为孵育基质,考察并验证氯氮平在体外孵育条件下(孵育温度为37 ºC,孵育时间为60 min)的反应代谢物。通过采用不同的数据采集和处理技术,对氯氮平在肝微粒体基质中孵育后的样品进行反应性代谢物筛查,并将检测结果同文献进行对比。
我们首先使用了LC-UV-HRMS高分辨质谱系统对待测样品进行紫外扫描和Full MS/ dd-MS2质谱扫描。通过将空白样品与氯氮平孵育60 min后的样品进行对比,可以观测到一些紫外信号较明显的代谢产物峰,例如8.65 min和9.33 min的色谱峰,如图5(A)所示。这些观测到的色谱峰并非全都是GSH结合产物,需要通过一级质谱和二级质谱进行结构解析才能确认。对于GSH结合物和非GSH结合物的确认过程必然会占用一定的分析时间,为了快速而又高通量的识别GSH结合物,我们使用选择离子监测(SIM)扫描GSH结合物特征碎片m/z 272.0888。这种检测方式可以在没有进行结构解析的情况下,快速的锁定GSH结合物,然后有目标性的找到对应保留时间下的一级质谱和二级质谱确认代谢物。通过这种扫描方式,可以检测到7个GSH结合物,如图5(B)所示。SIM扫描所得代谢物信息同UV扫描代谢物信息可以相互补充,通过目标离子提取最终确认了10个GSH结合产物,如图5(C)和表3所示。
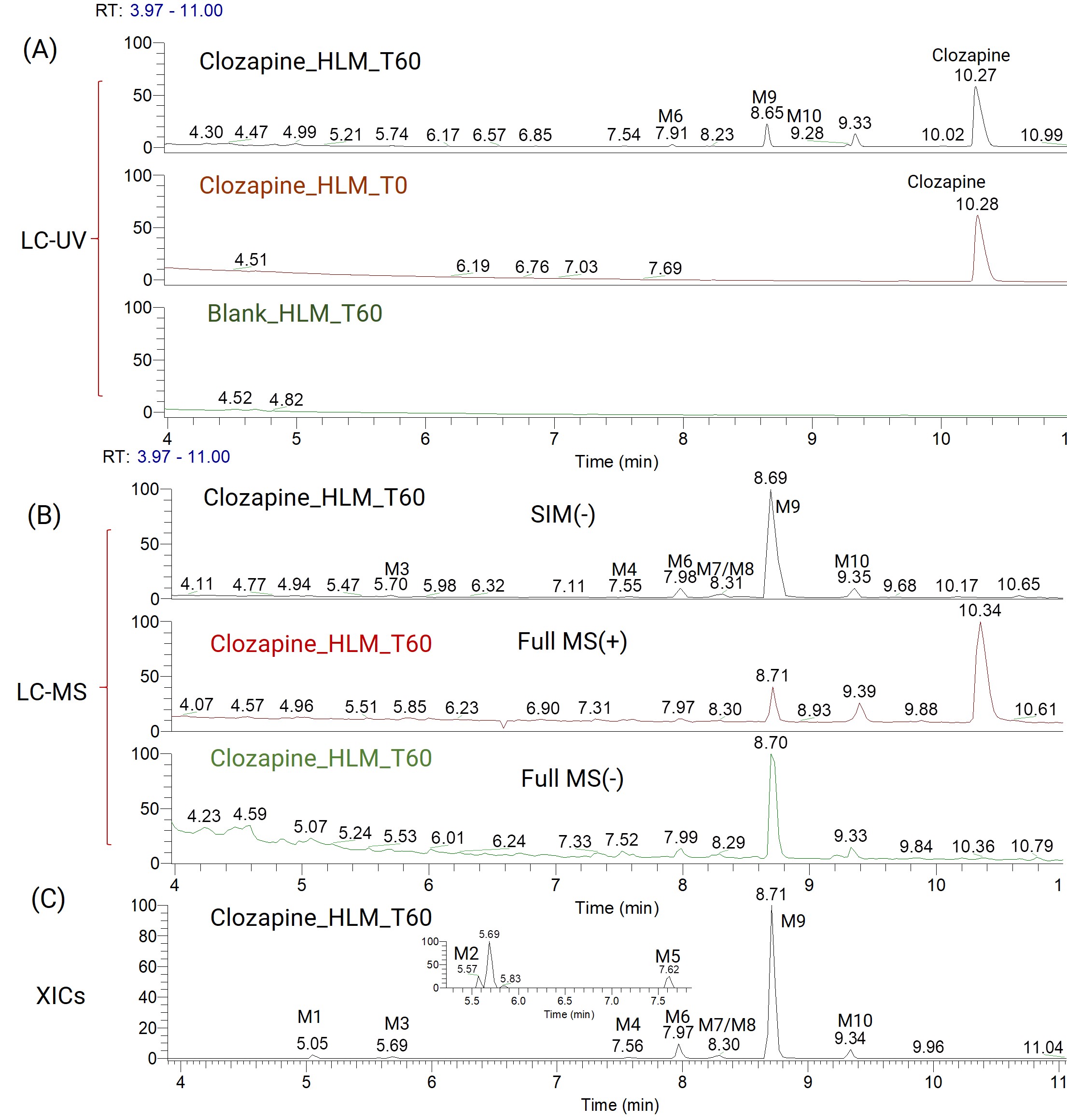
图5. 氯氮平肝微粒体孵育样品在LC-UV-HRMS采集后的LC-UV图(A)、LC-MS图(B)和提取离子流图(C)
表3. 氯氮平在高分辨质谱上的反应性代谢物检测结果
代谢物编号 | 质荷比 | 保留时间 | 质谱面积 | 质谱面积相对丰度% | 代谢途径 |
M1 | 598.24 | 5.05 | 2948613 | 1.99 | P – Cl + H + GSH |
M2 | 650.22 | 5.57 | 316556 | 0.21 | P + O + 2H + GSH |
M3 | 650.22 | 5.69 | 1801373 | 1.22 | P + O + 2H + GSH |
M4 | 632.20 | 7.56 | 860179 | 0.58 | P + GSH |
M5 | 618.19 | 7.62 | 457274 | 0.31 | P – CH2 + GSH |
M6 | 632.20 | 7.97 | 10342533 | 6.98 | P + GSH |
M7 | 648.20 | 8.24 | 999968 | 0.67 | P + O + GSH |
M8 | 618.19 | 8.30 | 2487525 | 1.68 | P – CH2 + GSH |
M9 | 632.20 | 8.71 | 121505305 | 81.99 | P + GSH |
M10 | 648.20 | 9.34 | 6467872 | 4.36 | P + O + GSH |
注:P代表母药,GSH: C10H15N3O6S
对于反应性代谢物检测,除了使用高分辨质谱检测系统的不同检测模式以外,还可以使用四极杆串联离子阱质谱仪进行样品分析。考虑到GSH结合物在正离子模式下容易发生-129 Da(焦谷氨酸)的中性丢失(NL),我们采用了NL-IDA-EPI扫描模式。对于产生129 Da中性丢失的母离子,自动触发产物离子扫描,获得二级质谱碎片信息。同时,为了减少假阳性信号,我们还采用PI-IDA-EPI扫描进行筛查。通过前体离子扫描(PI)检测m / z 272碎片,过滤掉大部分的基质干扰信息。经过一级和二级质谱确认,中性丢失扫描和前体离子扫描总共得到5个明显的GSH结合物(M1、M6、M8、M9和M10)。
从上述检测结果来看,四极杆串联离子阱质谱和高分辨质谱均可以实现对待测样品进行反应性代谢物筛查,主要代谢物M6、M9和M10在上述不同的质谱采集和分析模式下均有检测到。其中M6和M9的代谢途径为谷胱甘肽结合,与上文中提到的氯氮平代谢活化产生反应性亚胺离子的信息相吻合(图4)。高分辨质谱在仪器分辨率等方面具有一定的优势。通过与文献对比,实验检测结果与文献报道的内容一致[11](表4),这充分说明了反应性代谢物检测技术平台检测结果的准确性和可靠性。
表4. 氯氮平在肝微粒体孵育体系中反应性代谢物检测结果与文献对比
代谢物编号 | 本次实验结果 | 文献检测结果 [11] |
M1 | Y | Y |
M2 | Y | Y |
M3 | Y | Y |
M4 | Y | ND |
M5 | Y | Y |
M6 | Y | Y |
M7 | Y | Y |
M8 | Y | Y |
M9 | Y | Y |
M10 | Y | Y |
注:Y代表检测到代谢物,ND代表未检测到代谢物
反应性代谢物研究在药物研发过程中的应用
如前所述内容,在先导化合物发现和优化阶段,通过筛查可能的反应性代谢物,将候选药物的代谢活化倾向性降到最低,这也是结构优化阶段非常重要的一种优化策略。除此之外,在动物毒理试验以及临床试验各阶段,对反应性代谢物及下游代谢物的检测和结构表征,有利于阐明药物的毒性机制,从而找到减小或消除毒性的解决办法。

图6. 反应性代谢物在新药研发各阶段筛查策略 [12]
案例研究
对非尔氨酯(Felbamate)和舒多昔康(Sudoxicam)进行结构改造是反应性代谢物筛查在新药研发过程中典型的应用案例。
非尔氨酯是在1993年上市的抗癫痫药物 [13,14],其在人体内主要经酯酶水解、醛脱氢酶氧化,得到主要代谢物Metabolite 1(图7)。中间代谢物醛基氨甲酸酯(metabolite 4)非常不稳定,容易自发降解产生苯基丙烯醛(反应性代谢物)。苯基丙烯醛消耗人体内的谷胱甘肽,易与蛋白上的亲核基团发生共价结合,被认为是与非尔氨酯特异质毒性密切相关的反应性代谢物。在此信息的基础上,研发人员设计了氟代非尔氨酯(Fluorofelbamate),在与苯环相连的苄位碳原子上引入氟取代基,氟原子的引入阻滞了苯基丙烯醛反应性代谢物的产生,药物肝毒性明显降低。

图7. 非尔氨酯和氟代非尔氨酯的代谢途径[13, 14]
舒多昔康(Sudoxicam)曾在1970年代作为有效的非甾体抗炎药物进行开发,因临床试验中出现严重的肝毒性被终止。它的毒性被认为是与噻唑环代谢活化产生酰基硫脲物质(反应性代谢物)有关(图8)。随后,在舒多昔康噻唑环的5位引入甲基取代基,得到同系列药物美洛昔康(Meloxicam)。甲基作为噻唑环的代谢软点,使美洛昔康具有与舒多昔康完全不同的噻唑环代谢方式(甲基氧化成醇或进一步氧化成羧酸),在保持药效的基础上降低了母体药物的肝毒性。
 图8. 舒多昔康和美洛昔康的代谢途径[15]
图8. 舒多昔康和美洛昔康的代谢途径[15]
总而言之,对于新药研发,应采取各种措施来降低或避免药物可能产生的毒性。通过反应性代谢物筛查,尽早发现和修饰具有潜在毒性的化合物,对药物的安全性问题起到一定的预测作用。对于动物或临床试验中实际观察到的药物毒性,在没有足够的实验数据支持下,很难将它归结为某一个具体的代谢物所引起,然而,了解这个过程中可能产生的反应性代谢物,能够指明一个方向,或者提出一个假设,从而提高药物研发成功率。
结语
在药物研发过程中尤其是在药物发现的早期阶段,筛查药物代谢可能的反应性代谢物,有助于理解一个药物潜在的安全性问题,从而利用化学干预的方法,找到等效的替代药物分子,这对于提高用药安全性具有重要意义。药明康德DMPK依托高分辨质谱技术、多元化的分析软件、优秀的专业人才和雄厚的仪器设备力量,服务于全球多家药物研发企业机构,已完成了近千次多种类型的反应性代谢物筛查实验。药明康德DMPK致力于为全球客户提供高质量的数据和卓越的服务,满足客户项目的个性化需求。
作者:王慧娟,李瑞兴,曹卫群
编辑:方健,钱卉娟
设计:倪德伟
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系。
参考
1. Scott Obach R., Kalgutkar A.S. Reactive Electropiles and Metabolic Activation. Comprehensive Toxicology, 2010, 309-347.
2. Miller JA. Carcinogenesis by chemicals: an overview--G. H. A. Clowes memorial lecture. Cancer Res. 1970, 30(3):559-76.
3. Liebler DC. Protein damage by reactive electrophiles: targets and consequences. Chem Res Toxicol. 2008, 21(1):117-28.
4. Athersuch TJ, Antoine DJ, Boobis AR, Coen M, Daly AK, Possamai L, Nicholson JK, Wilson ID. Paracetamol metabolism, hepatotoxicity, biomarkers and therapeutic interventions: a perspective. Toxicol Res (Camb). 2018, 7 (3):347-357.
5. Jollow DJ, Mitchell JR, Potter WZ, Davis DC, Gillette JR, Brodie BB. Acetaminophen-induced hepatic necrosis. II. Role of covalent binding in vivo. J Pharmacol Exp Ther. 1973, 187(1):195-202.
6. Uetrecht JP. Metabolism of drugs by leukocytes. Drug Metabol Drug Interact. 1994, 11(4):259-82.
7. Stepan AF, Walker DP, Bauman J, Price DA, Baillie TA, Kalgutkar AS, Aleo MD. Structural alert/reactive metabolite concept as applied in medicinal chemistry to mitigate the risk of idiosyncratic drug toxicity: a perspective based on the critical examination of trends in the top 200 drugs marketed in the United States. Chem Res Toxicol. 2011, 24(9):1345-410.
8. Craveiro NS, Lopes BS, Tomás L, Almeida SF. Drug Withdrawal Due to Safety: A Review of the Data Supporting Withdrawal Decision. Curr Drug Saf. 2020, 15(1):4-12.
9. Kalgutkar AS, Gardner I, Obach RS, Shaffer CL, Callegari E, Henne KR, Mutlib AE, Dalvie DK, Lee JS, Nakai Y, O'Donnell JP, Boer J, Harriman SP. A comprehensive listing of bioactivation pathways of organic functional groups. Curr Drug Metab. 2005, 6(3):161-225.
10. Kalgutkar AS, Dalvie D. Predicting toxicities of reactive metabolite-positive drug candidates. Annu Rev Pharmacol Toxicol. 2015, 55:35-54.
11. Wang Z, Fang Y, Rock D, Ma J. Rapid screening and characterization of glutathione-trapped reactive metabolites using a polarity switch-based approach on a high-resolution quadrupole orbitrap mass spectrometer. Anal Bioanal Chem. 2018, 410(5):1595-1606.
12. Wen B, Fitch WL. Analytical strategies for the screening and evaluation of chemically reactive drug metabolites. Expert Opin Drug Metab Toxicol. 2009, 5(1):39-55.
13. Thompson CD, Barthen MT, Hopper DW, Miller TA, Quigg M, Hudspeth C, Montouris G, Marsh L, Perhach JL, Sofia RD, Macdonald TL. Quantification in patient urine samples of felbamate and three metabolites: acid carbamate and two mercapturic acids. Epilepsia. 1999, 40(6):769-76.
14. Parker RJ, Hartman NR, Roecklein BA, Mortko H, Kupferberg HJ, Stables J, Strong JM. Stability and comparative metabolism of selected felbamate metabolites and postulated fluorofelbamate metabolites by postmitochondrial suspensions. Chem Res Toxicol. 2005, 18(12):1842-8.
15. Obach RS, Kalgutkar AS, Ryder TF, Walker GS. In vitro metabolism and covalent binding of enol-carboxamide derivatives and anti-inflammatory agents sudoxicam and meloxicam: insights into the hepatotoxicity of sudoxicam. Chem Res Toxicol. 2008, 21(9):1890-9.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息