近年来,随着单克隆抗体与Fc工程技术的飞速发展,免疫系统中一个曾被长期忽视的受体——新生儿Fc受体(neonatal Fc receptor, FcRn),正逐渐成为药物研发的焦点。特别是在自身免疫疾病治疗领域,FcRn作为调控IgG抗体半衰期的核心“守门人”,已展现出作为治疗靶点的巨大潜力。本文将从FcRn的作用机制出发,梳理靶向FcRn的药物研发进展与已上市药物,并深入探讨其在药物分析与生物检测中的关键关注点,以期为这一前沿领域的药物研发提供参考。
FcRn作用机制及靶向治疗的基本原理
FcRn靶向治疗多针对自身免疫疾病。自身免疫疾病主要可分为两类:器官特异性与系统性。
器官特异性由自身抗体直接攻击特定器官抗原引发,导致局部炎症和组织损伤。如重症肌无力(myasthenia gravis, MG)、免疫性血小板减少症(immune thrombocytopenia, ITP)、抗肾小球基底膜病(Goodpasture’s syndrome)以及自身免疫性溶血性贫血(autoimmune hemolytic anemia, AHA)等;
系统性由自身抗体与游离分子、细胞表面抗原或核蛋白抗原结合,形成致病性免疫复合物(immune complexes, ICs)所致,如类风湿关节炎(rheumatoid arthritis, RA)、系统性红斑狼疮(systemic lupus erythematosus,SLE)以及冷球蛋白症性血管炎(cryoglobulin vasculitis, CV)。
在器官特异性自身免疫疾病中,IgG类自身抗体靶向攻击特定组织中的抗原,而FcRn介导的抗体回收机制延长了这些致病性IgG在血液或组织中的存留时间,从而加剧免疫损伤。应用FcRn抑制剂可加速此类抗体的清除,减轻其对特定组织的攻击。以寻常型天胞疮(pemphigus vulgaris,PV)为例,使用Efgartigimod阻断FcRn后,能够保护角质形成细胞单层免受抗Dsg3-IgG介导的黏附破坏,减轻抗体对角质细胞造成的黏合剥离。表明FcRn抑制不仅在系统循环中起效,在局部组织保护中也发挥关键作用[4]。
对于系统性自身免疫疾病,其核心病理环节是体内产生大量致病性IgG自身抗体,通过激活补体或沉积于组织引发炎症损伤。传统治疗如广谱免疫抑制或抗CD20药物往往起效缓慢、易复发且副作用显著。靶向FcRn的药物提供了一种新颖且快速起效的治疗策略:通过竞争性抑制Fc片段与FcRn的结合,促进IgG(包括致病性自身抗体)在溶酶体中降解,从而显著降低血清IgG水平。值得注意的是,该策略不影响IgM、IgA等其他免疫球蛋白类别,亦不影响疫苗诱导的免疫记忆[5]。
FcRn靶向药物的研发进展
基于上述机制,目前靶向FcRn的药物主要围绕两大策略展开:
利用高亲和力分子与IgG竞争性结合FcRn,阻断IgG的回收通路,从而促进其降解[6];
开发在中性与酸性pH条件下均能有效结合FcRn的分子,实现细胞内外的全面阻断,涵盖肽类、针对FcRn的单克隆抗体(mAbs)或FcRn特异性Fab片段融合蛋白、Fc工程化IgG以及affibody蛋白等多种形式[7]。
这些临床前研究结果(如图1所示)为后续在IgG介导的自身免疫性疾病中开展FcRn靶向治疗奠定了坚实基础。
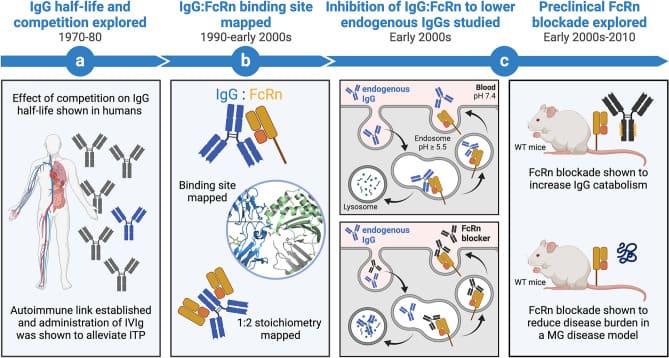
图1. FcRn在疾病中的功能研究发展路程[7]
目前,已有五款FcRn拮抗剂进入临床开发阶段,另有多个蛋白类分子处于临床前研究阶段,预计将于2025-2026年进入临床。表1汇总了这些候选药物的特征及临床前与临床数据[7]。
截止目前,已有两款FcRn拮抗剂获批上市:
Efgartigimod(阿加替吉单抗Fc片段,ARGX-113,商品名VYVGART)为首个获FDA批准(2021年)的FcRn拮抗剂,用于治疗抗AChR抗体阳性的成人全身型重症肌无力。该药已开发静脉与皮下两种剂型可灵活适应不同临床需求,并已在特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)、慢性炎症性脱髓鞘性多发性神经病(chronic inflammatory demyelinating polyneuropathy,CIDP)、寻常型天胞疮(pemphigus vulgaris,PV)等多种自身免疫病中开展临床研究。
Rozanolixizumab(罗纳珠单抗,商品名Rystiggo)为首个皮下给药的FcRn拮抗剂,于2023年获批,用于治疗抗AChR或抗MuSK抗体阳性的成人全身型重症肌无力。
这两款药物的成功上市,从临床层面验证了“降低循环IgG水平即可带来治疗获益”的核心机制,为FcRn靶向疗法的进一步发展提供了重要依据。
表1. 已获批准并处于研发阶段的FcRn拮抗剂
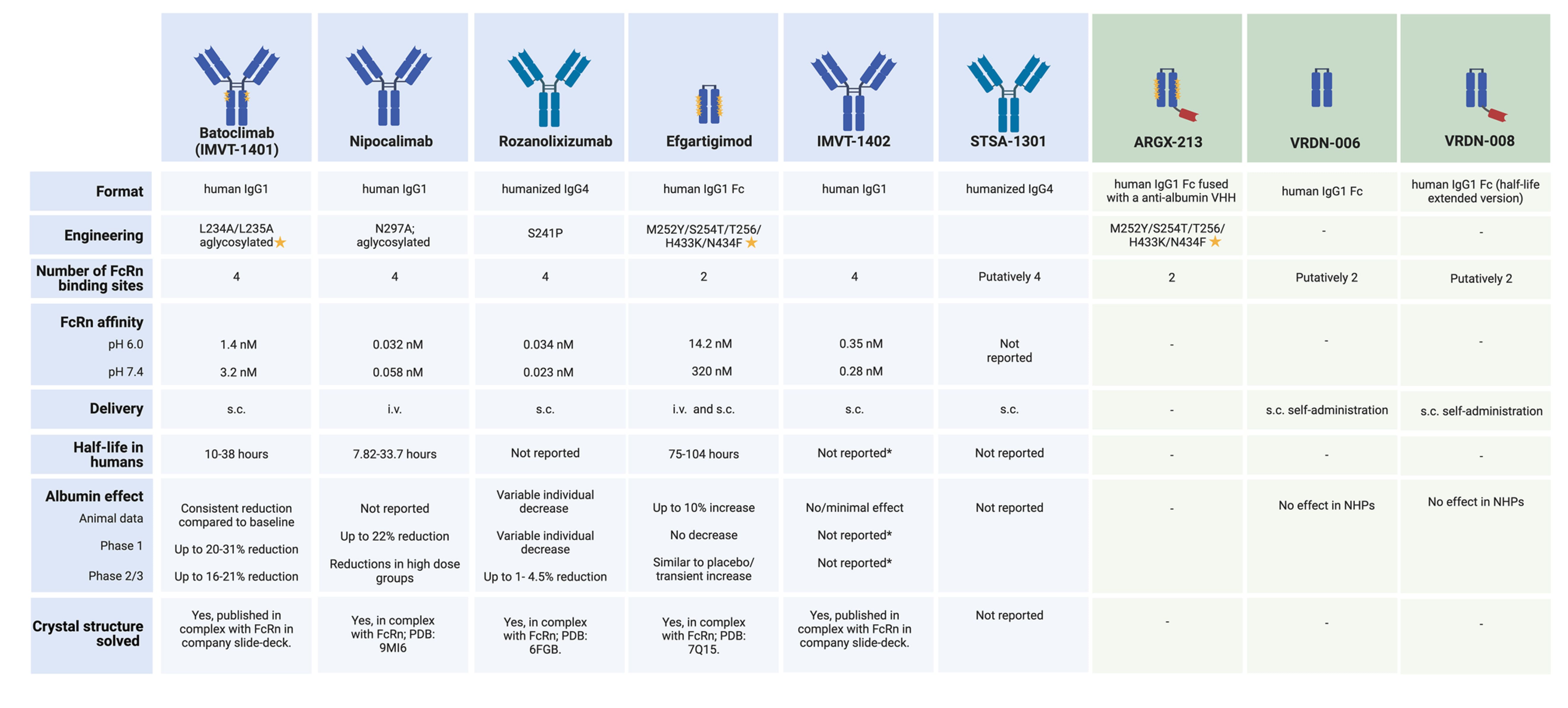
蓝色:积极临床开发和/或使用阶段,绿色:临床前阶段。
FcRn靶向药物的生物分析策略与关键指标
在 FcRn 靶向药物的开发过程中,合理选择PK/PD指标对评估药效与安全性至关重要。与此同时,选择合适的生物分析平台更是精准评估药代药效和安全性的关键。配体结合分析法(LBA)是大分子化合物生物分析的金标准,普遍应用于各类大分子药物的生物分析中。对于FcRn药物来讲,LBA平台可同时支持其PK、PD以及免疫原性等分析,为该类药物的研发提供综合的分析平台。
FcRn药物的PK分析
药代动力学(PK)主要通过监测药物在血液中的浓度变化来计算半衰期及清除率,以评估其体内暴露特征和给药方案的合理性。
FcRn抗体类药物多为Human IgG或其片段结构(如 Fc 片段、Fab 端融合蛋白等),在PK分析时可针对其抗体骨架进行检测。常规的generic method可利用一些结合Fc、重链/轻链或Fab保守区的抗体进行检测。在小鼠、大鼠等啮齿类动物的检测中往往比较常规;但是在非人灵长类(与Human同源性较高)的种属中,要格外注意检测试剂与样本中内源性IgG的交叉反应而导致的信号干扰。这种干扰可能表现为检测结果呈假阳性(因非特异结合信号放大)或假阴性(因结合位点被竞争性占用)。因此,PK的分析方法需具备高灵敏度和特异性,能够有效区分药物本身与内源性IgG的信号,使PK的检测互不干扰。为了提高检测特异性与准确性,通常采用以下策略(图2):
选择针对独特表位的anti-idiotype抗体;
优化酸解条件;
引入竞争性清除步骤;
此外,治疗期间患者总IgG水平的快速动态变化会对检测体系的背景信号、样本稀释比例及校准曲线线性范围产生显著影响。因此,在长期监测中需特别关注采样时点的选择(例如给药后 IgG 快速下降阶段与回升阶段)、稀释线性验证及个体免疫状态变化。
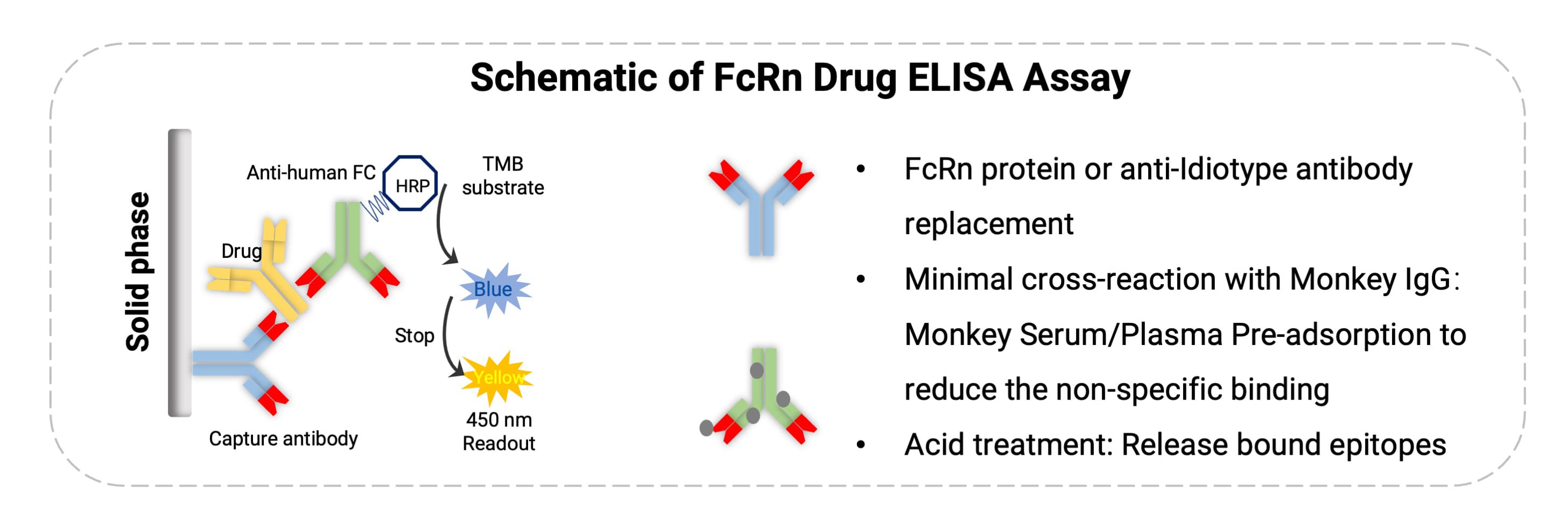
图2. FcRn抗体药物的分析策略
2015年的一项研究评估了efgartigimod在健康志愿者中的药代动力学特征,其在单次给药研究(SAD)中的血药浓度如下图所示:测量使用针对efgartigimod的ELISA(利用专有的efgartigimod特异性捕获抗体测定,其定量下限为300 ng/mL),PK参数采用非区室方法计算。efgartigimod在健康志愿者中表现为静脉给药后迅速达峰(2 h)、AUC 在中高剂量呈剂量比例关系、有效分布(Vz≈15-21L)且半衰期约3.5-4.5天,尿排泄极少;多次给药无明显蓄积,为后续以IgG快速、可控下降为目标的给药策略提供了可靠的PK基础。其PK参数如下图3所示[8]:
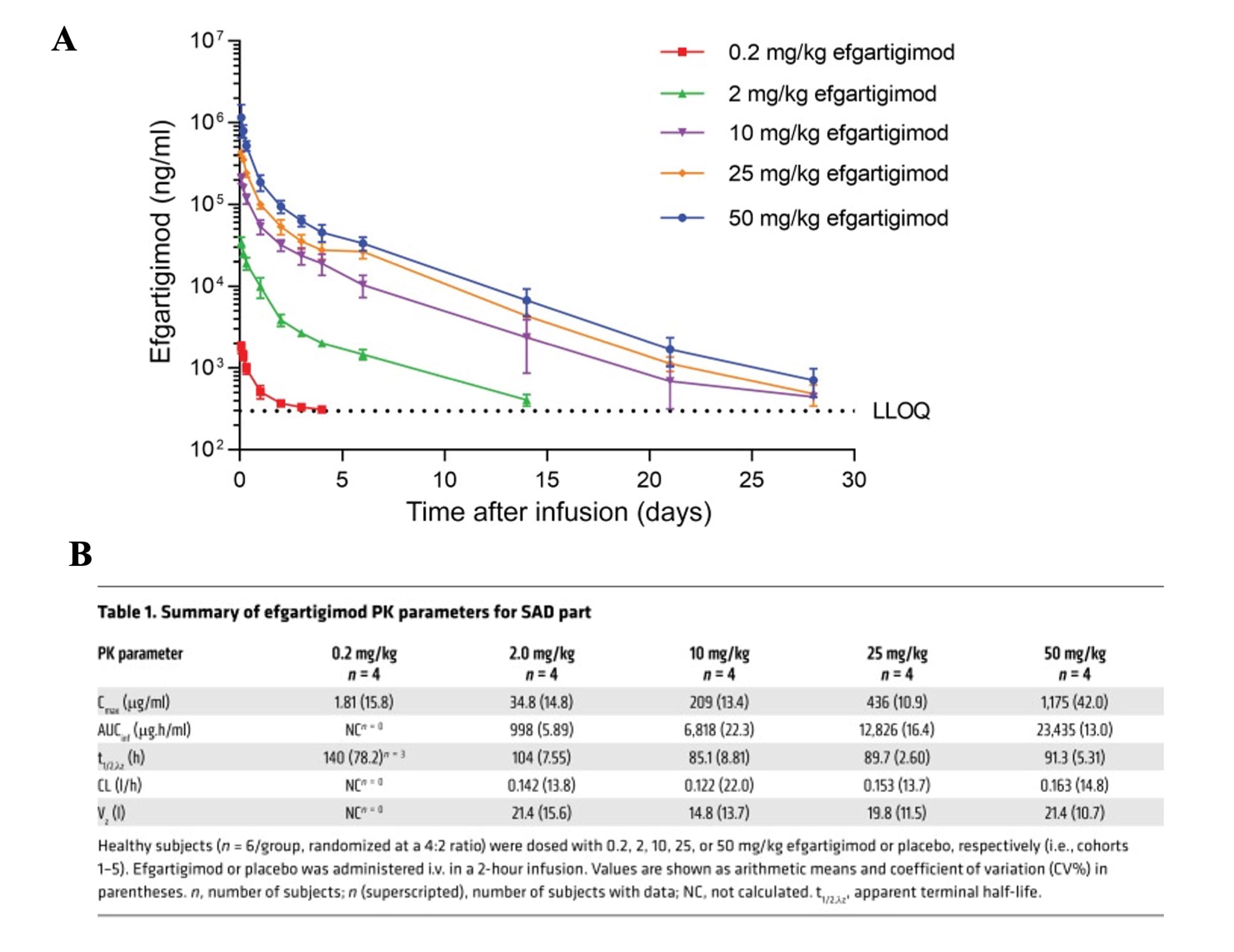
图3. Efgartigimod抗体药物在人体实验中的血药浓度和PK参数[8]
FcRn药物的PD分析
对于FcRn抑制剂类药物的药效动力学(PD)层面,一般会重点关注:总IgG水平的下降幅度、特异性自身抗体(如AChR抗体、血小板相关抗体)的动态变化、IgG各亚类(IgG1-4)的比例变化,以及血浆白蛋白水平(用于评估FcRn抑制可能引发的低蛋白血症风险)[7]。
在上市药物efgartigimod的人体实验中,与安慰剂组相比,单剂量2-50 mg/kg的efgartigimod给药后,观察到IgG水平(包括IgG1、IgG2、IgG3、IgG4)迅速、持续且依赖剂量下降。有趣的是,不同IgG亚型水平随时间的降低非常相似,尽管IgG4的降低程度略小。这可能表明IgG4的产生速率或FcRn相互作用谱与其他IgG亚型不同。Efgartigimod的使用未显著改变IgA、IgD、IgE和IgM水平,因为这些免疫球蛋白的内源性水平不依赖于FcRn介导的循环[8]。
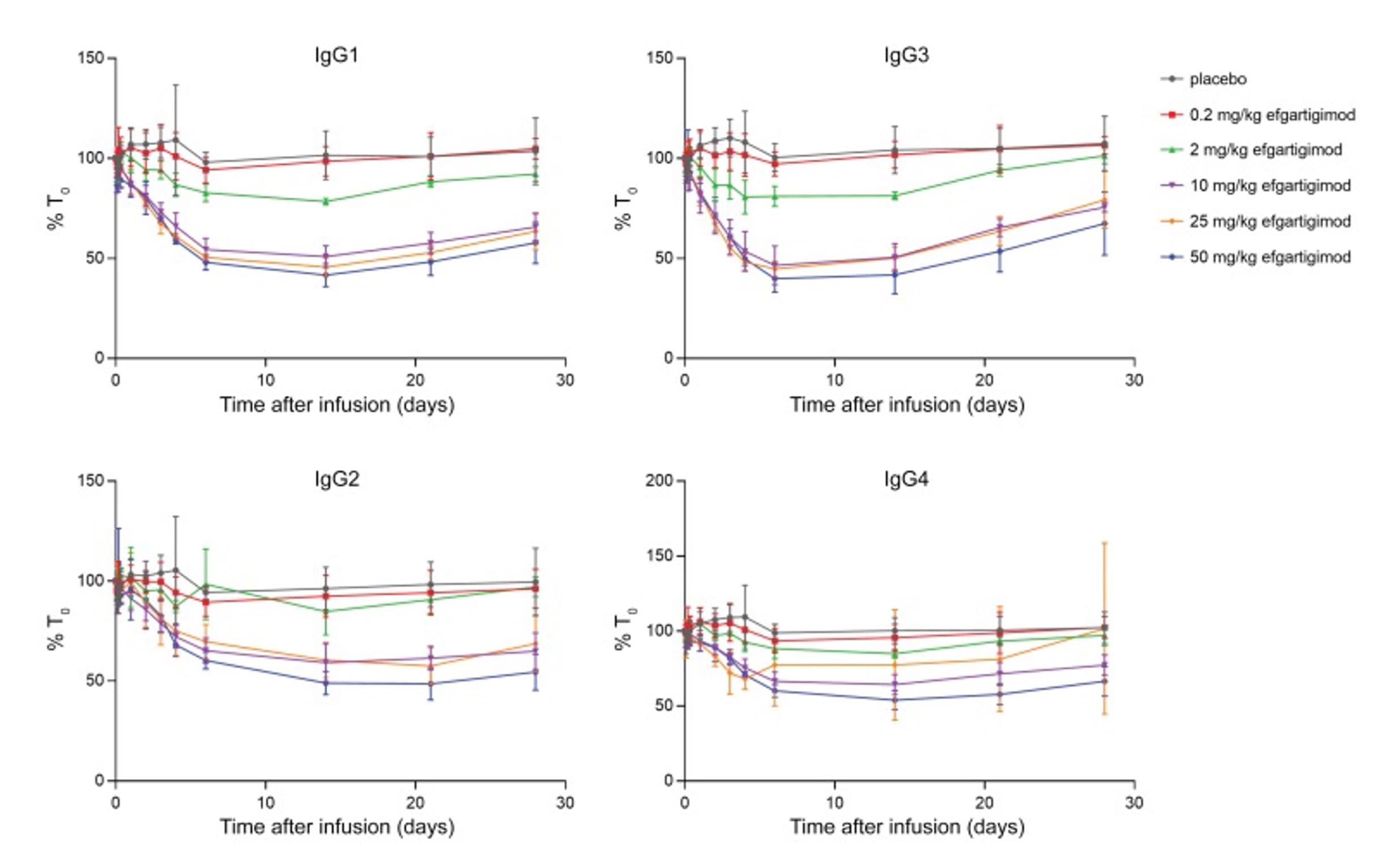
图4. Efgartigimod抗体药物在首次人体研究中血清中IgG亚类的水平随时间变化[8]
由于食蟹猴IgG和人类IgG的FcRn结合特性非常相似,并且efgartigimod对人类FcRn的亲和力增加与对食蟹猴FcRn的亲和力增加相似,因此食蟹猴被认为是探索efgartigimod药效学特性的相关物种。
对于食蟹猴内源IgG的分析,除常规的临床生化检测外,还可通过ELISA方法实现更高灵敏度和特异性的定量(见图5)。目前,药明康德DMPK已建立并系统性验证了内部的Monkey IgG ELISA方法。由于多数FcRn靶向药物基于Human IgG 骨架,与Monkey IgG具有较高同源性,因此许多市售或定制的检测抗体可同时识别Monkey IgG与Human IgG。在开展Monkey IgG定量时,药物本身(Human IgG架构)可能带来潜在干扰,因此需要重点评估其对测定的影响。基于我们的实验结果,在50-5000 ng/mL 的Monkey IgG线性范围内,加入10-250 ng/mL的Human IgG(模拟药物存在)对Monkey IgG的检出无显著干扰。该耐受水平可覆盖至500 mpk给药剂量时的药物Cmax 水平,确保方法在药物高暴露情况下依然适用。
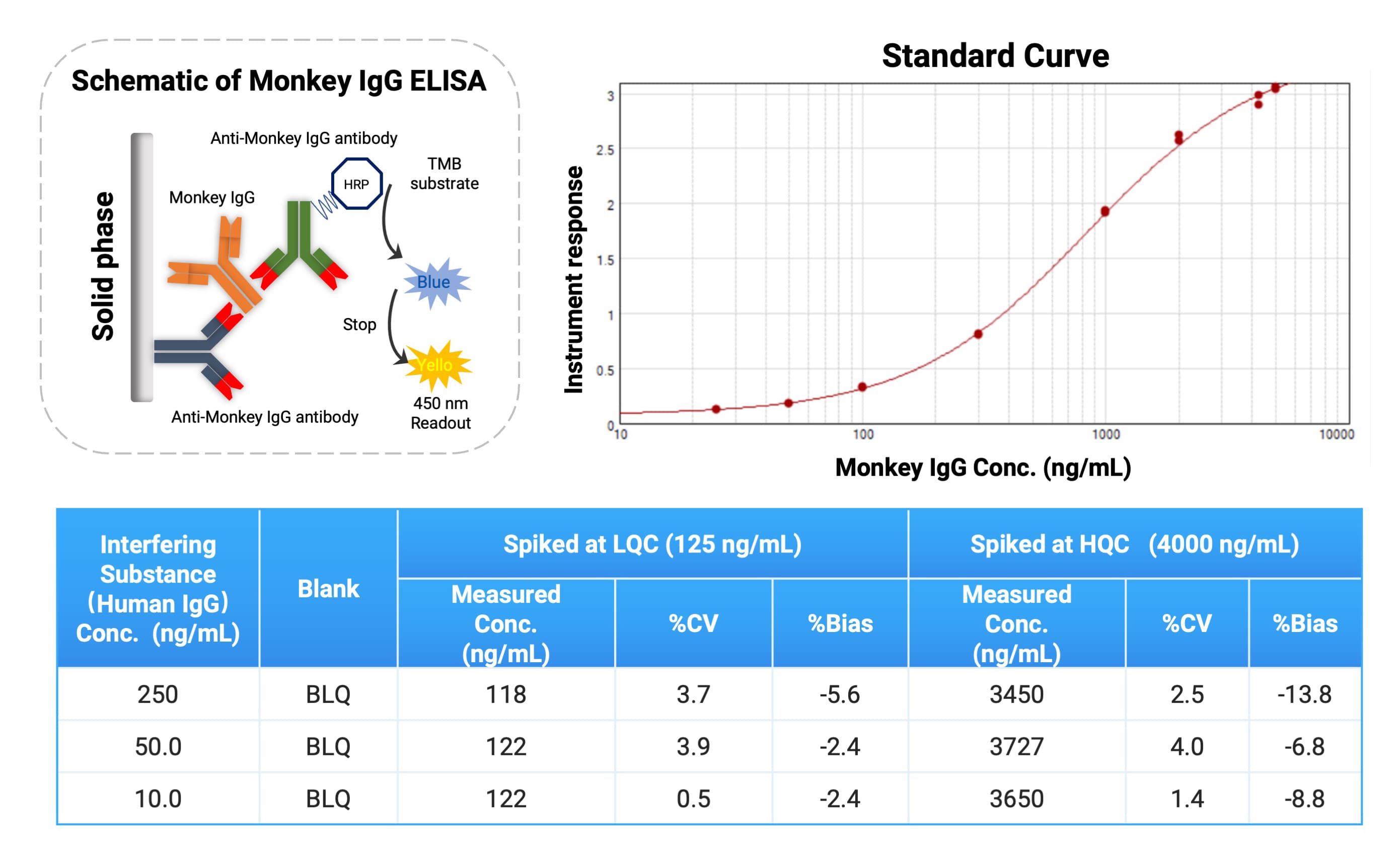
图5. 内源性Monkey IgG的分析策略
另外值得注意的是,Monkey IgG内源水平具有较大的个体水平差异,我们通过数个个体计算出Monkey IgG的基线水平以供参考,在此类药物的PK/PD实验中,往往需要基于Monkey IgG基线水平对给药动物进行预筛选,确保筛选出处于合适水平的动物个体用于体内研究(图6)。
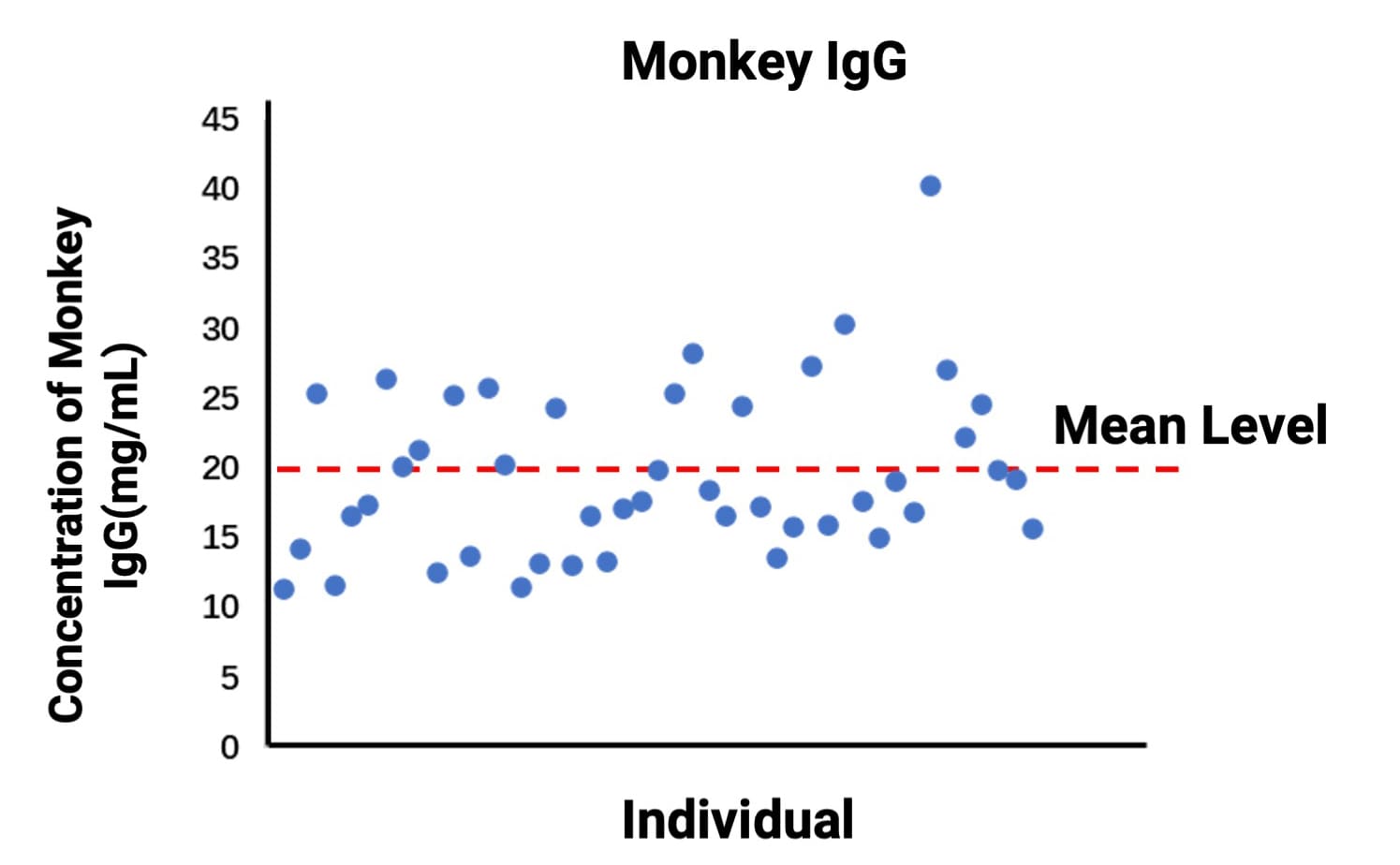
图6. 内源性Monkey IgG的基线水平
免疫原性评估的特殊考量
作为生物大分子类药物,FcRn抑制剂可能诱导抗药抗体(ADA)的产生。一旦出现ADA阳性,可能会影响药物的药代动力学和药效动力学特征,导致药物暴露下降、疗效减弱,甚至增加免疫相关的不良反应风险。值得注意的是,由于FcRn抑制剂会显著降低体内总IgG水平,背景IgG的下降可能改变ADA检测的基线水平与信号强度,从而影响检测灵敏度与阈值设定。因此,在ADA分析方法的设计与验证中,必须充分考虑这一特殊因素,确保结果准确可靠。
综合分析策略
FcRn抑制剂的分析检测需要在灵敏度、特异性与方法稳健性之间取得平衡。通过优化方法学设计与验证策略,才能确保药物暴露和免疫反应的准确评估,为临床开发提供可靠的数据支持。
这一分析框架不仅适用于已上市的FcRn抑制剂,也为同类在研药物的生物分析提供了重要参考。
结语
靶向FcRn为自身免疫疾病的治疗提供了创新的解决路径。其核心机制在于“让致病IgG更快被清除、存留时间更短、作用机会更少”。无论是器官特异性还是系统性自身免疫疾病,FcRn在其中的共同角色都是“延长致病性IgG的半衰期”。针对这一环节的干预,为传统治疗手段难以奏效的患者提供了新的希望。
与传统的广谱免疫抑制疗法相比,FcRn靶向治疗展现出独特优势:作用机制更具选择性、临床应答更快,且潜在副作用更小,使其成为当前自身免疫疾病治疗领域的重要发展方向。
药明康德DMPK拥有成熟全面的配体结合分析平台,具备从早期筛选到IND申报的全流程项目经验。我们在PK/PD样本分析、生物标志物监测及免疫原性评估方面拥有全面分析能力,目前已进行了数十个FcRn的靶向药物的项目,在此类项目的生物分析上具有丰富的经验。在FcRn靶向药物(如抗体、融合蛋白等)研发过程中,我们能够提供:
候选药物的体内PK特征评估;
药物降低IgG水平的PD效应分析;
免疫原性风险监测;
此外,我们的LBA平台还可与LC-MS/MS、qPCR及流式细胞术(flow cytometry)等技术平台协同整合,为FcRn靶向药物的研发提供高质量的分析支持与数据支撑。
作者:张多,张雪,任文瑞,颜欢,宋苗苗,邢丽丽
编辑:富罗娜·克里木,钱卉娟
设计:张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系
参考
[1] Saxena A, Wu D. Advances in Therapeutic Fc Engineering - Modulation of IgG-Associated Effector Functions and Serum Half-life. Front Immunol. 2016;7:580.
[2] Patel DD, Bussel JB. Neonatal Fc receptor in human immunity: Function and role in therapeutic intervention. J Allergy Clin Immunol. 2020;146(3):467-78.
[3] Pyzik M, Kozicky LK, Gandhi AK, Blumberg RS. The therapeutic age of the neonatal Fc receptor. Nat Rev Immunol. 2023;23(7):415-32.
[4] Zakrzewicz A, Vanderheyden K, Galaly Y, Feldhoff S, Sips M, Brinkhaus M, Tikkanen R. Binding to the neonatal Fc receptor enhances the pathogenicity of anti-desmoglein-3 antibodies in keratinocytes. Front Immunol. 2024;15:1473637.
[5] Howard JF, Jr., Bril V, Vu T, Karam C, Peric S, De Bleecker JL, et al. Long-term safety, tolerability, and efficacy of efgartigimod (ADAPT+): interim results from a phase 3 open-label extension study in participants with generalized myasthenia gravis. Front Neurol. 2023;14:1284444.
[6] Zhu LN, Hou HM, Wang S, Zhang S, Wang GG, Guo ZY, Wu J. FcRn inhibitors: a novel option for the treatment of myasthenia gravis. Neural Regen Res. 2023;18(8):1637-44.
[7] Gjolberg TT, Mester S, Calamera G, Telstad JS, Sandlie I, Andersen JT. Targeting the Neonatal Fc Receptor in Autoimmune Diseases: Pipeline and Progress. BioDrugs. 2025;39(3):373-409.
[8] Ulrichts P, Guglietta A, Dreier T, van Bragt T, Hanssens V, Hofman E, et al. Neonatal Fc receptor antagonist efgartigimod safely and sustainably reduces IgGs in humans. J Clin Invest. 2018;128(10):4372-86.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息