抗体偶联药物(antibody-drug conjugate,ADC)是一类将特异性抗体与细胞毒药物通过连接子偶联而成的靶向治疗药。其治疗关键在于药物在靶组织的选择性富集与对肿瘤细胞的高效杀伤,这要求ADC在血液循环中保持稳定以避免脱靶毒性,且在靶部位响应特定生化刺激以释放有效载荷。在ADC研发管线中,连接子设计是非常重要的环节,它直接影响ADC循环稳定性及有效载荷释放,是平衡疗效与安全性的关键。本文将从ADC连接子可切割位点设计、与抗体偶联的官能团选择、自消除间隔区和亲水性修饰等维度介绍连接子设计策略,并探讨优化连接子设计的DMPK体外评估方法,为ADC研发提供参考。
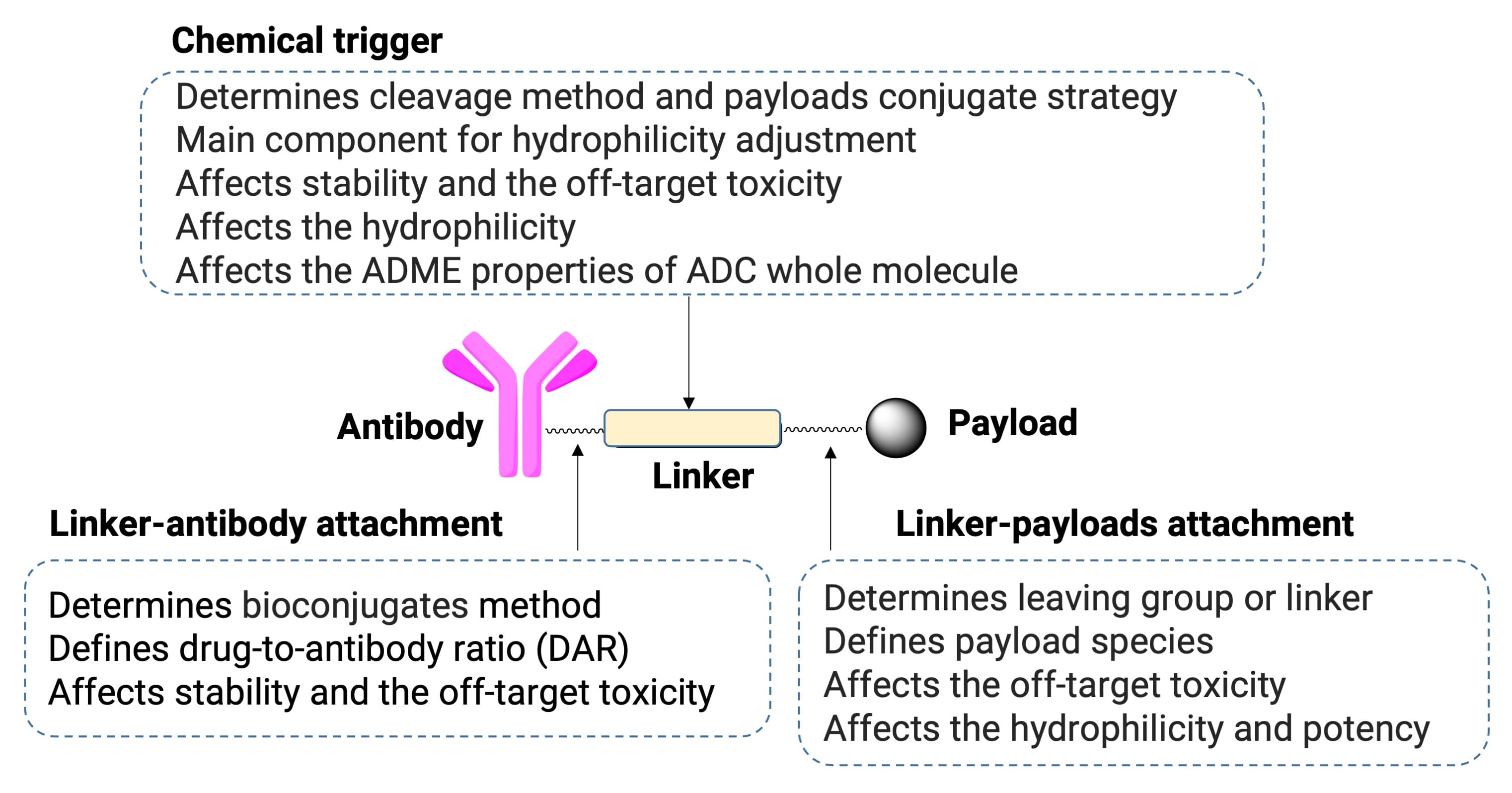
图1. ADC典型结构及连接子功能特点[1]
连接子分类及已批准上市的ADC
根据有效载荷释放机制,ADC连接子主要分为可切割型和不可切割型两大类(图2)。
不可切割连接子(如赖氨酸-MCC)因其优异的血浆稳定性在ADC设计中占有重要地位。当ADC被肿瘤细胞内化后,抗体部分在溶酶体中被蛋白酶水解,释放带有氨基酸残基的连接子-有效载荷复合物。由于该复合物通常含有亲水性氨基酸残基,其细胞膜渗透性较差,因此这类ADC主要对靶抗原高表达的肿瘤细胞具有杀伤作用。
相比之下,可切割连接子(如pH敏感型腙键、还原敏感型二硫键和酶敏感型肽连接子)通过响应肿瘤细胞或微环境特定生化刺激实现有效载荷可控释放。释放的有效载荷通常具有疏水性及较强的透膜能力,不仅能杀伤靶抗原高表达的肿瘤细胞,还能通过"旁观者效应"作用于邻近的抗原低表达或阴性肿瘤细胞,从而克服肿瘤异质性。这种可控的释放机制与有效载荷膜穿透特性相结合,使可切割型ADC在实体瘤治疗中展现出独特优势。
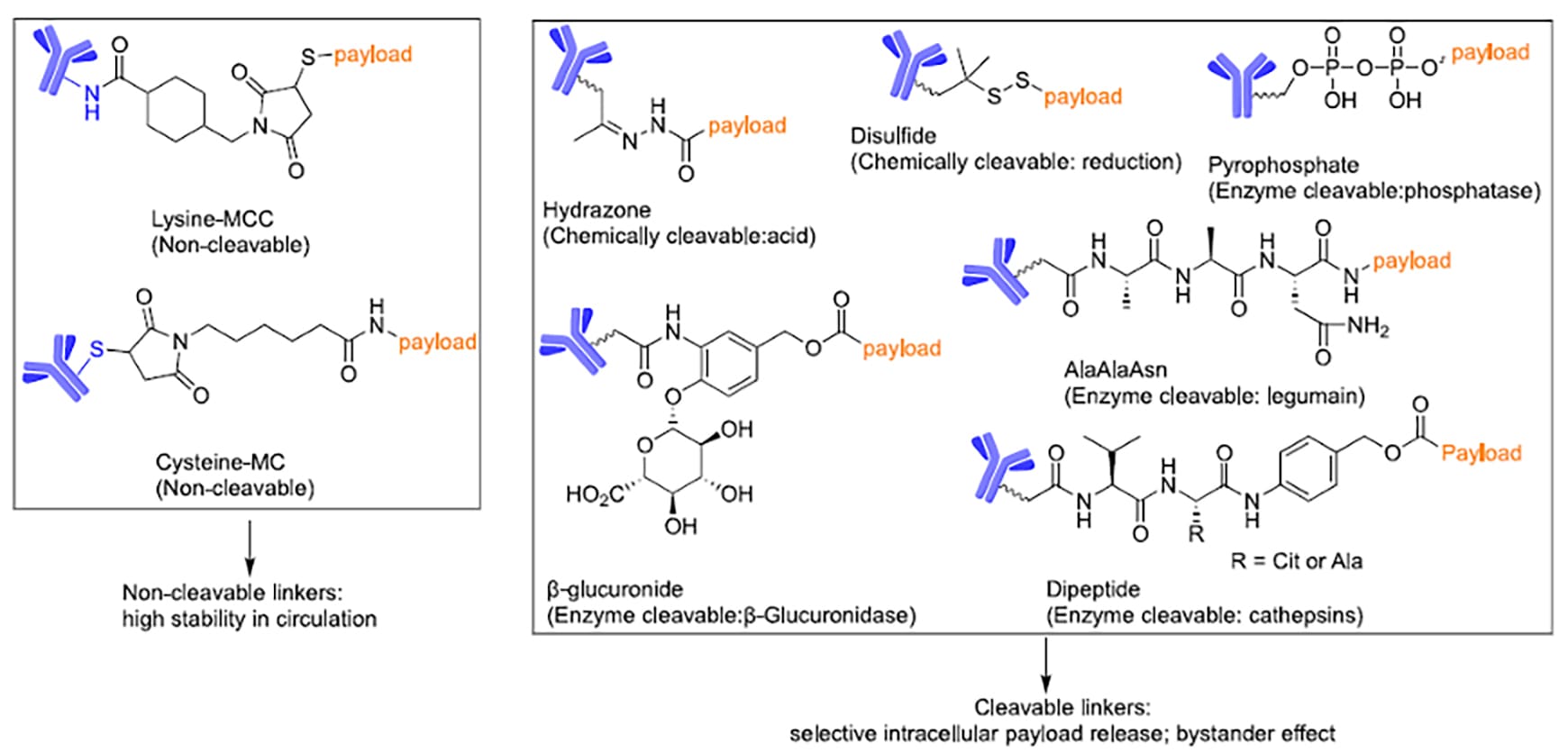
图2. ADC连接子分类及化学结构[2]
截至2025年12月,全球已有21款ADC获批上市(表1)。从连接子类型分析,主要为可切割连接子(17种),其中12种为酶可切割连接子。这一趋势在临床研发中同样显著,超过50%的临床在研ADC采用了酶可切割连接子。由此可见,可切割连接子在ADC药物研发中占据主导地位,而酶切类设计在连接子中广泛应用。
表1. 全球已批准上市的21款ADC一览[2]
首次批准年份 | 药物名称 | 商品名 | 靶点 | 连接子 | 有效载荷 | DAR |
2000 | Gemtuzumab ozogamicin | Mylotarg | CD33 | Hydrazone/disulfide | Calicheamicin | 2-3(Lys) |
2011 | Brentuximab vedotin | Adcetris | CD30 | MC-VCit-PABC | MMAE | 4 (Cys) |
2013 | Trastuzumab emtansine | Kadcyla | HER2 | SMCC (不可切割) | DM1 | 3.5(Lys) |
2017 | Inotuzumab ozogamicin | Besponsa | CD22 | Hydrazone/disulfide | Calicheamicin | 6 (Lys) |
2018 | Moxetumomab pasudotox | Lumoxiti | CD22 | NA | PE-38 | NA |
2019 | Polatuzumab vedotin | Polivy | CD79b | MC-VCit-PABC | MMAE | 3-4(Cys) |
2019 | Enfortumab vedotin | Padcev | Nectin-4 | MC-VCit-PABC | MMAE | 3.8(Cys) |
2019 | Trastuzumab deruxtecan | Enhertu | HER2 | MC-GGFG-AM | Dxd | 8(Cys) |
2020 | Sacituzumab govitecan | Trodelvy | TROP-2 | CL2A(碳酸酯) | SN-38 | 7.6(Cys) |
2020 | Belantamab mafodotin | Blenrep | BCMA | MC (不可切割) | MMAF | 4(Cys) |
2020 | Cetuximab Sarotalocan | Akalux | EGFR | Linear alkyl/alkoxy liner (不可切割) | IRDYE700 | 1.3-3.8(Lys) |
2021 | Tisotumab vedotin | Tivdak | TF | MC-VCit-PABC | MMAE | 4(Cys) |
2021 | Loncastuximab tesirine | Zynlonta | CD19 | Mal-PEG8-Val-Ala-PABC | PBD Dimer | 2.3(Cys) |
2021 | Disitamab vedotin | Aidixi | HER2 | MC-VCit-PABC | MMAE | 4(Cys) |
2022 | Mirvetuximab soravtansine | Elahere | FRα | Sulfo-SPDB(二硫键) | DM4 | 3.5(Lys) |
2024 | Sacituzumab tirumotecan | 佳泰莱 | TROP2 | Modifed CL2A | KL610023 | 7.4(Cys) |
2024 | Datopotamab deruxtecan | Datroway | TROP2 | MC-GGFG-AM | Dxd | 4(Cys) |
2025 | Telisotuzumab vedotin | Emrelis | c-Met | MC-VCit-PABC | MMAE | 3.1(Cys) |
2025 | Trastuzumab rezetecan | 艾维达 | HER2 | MC-GGFG-AM | SHR9265 | 6(Cys) |
2025 | Trastuzumab botidotin | 舒泰莱 | HER2 | VCit | Duostatin-5 | 2(Lys) |
2025 | Becotatug vedotin | 美佑恒 | EGFR | MC-VCit-PABC | MMAE | 4(Cys) |
ADC连接子可切割位点设计
化学可切割连接子
早期取得临床成功的ADC采用了pH敏感型连接子设计,如已上市ADC药物Mylotarg含有腙键结构和Trodelvy含有碳酸酯键结构(图3)。这类连接子在生理pH值(~7.4)下相对稳定,而在肿瘤细胞内体/溶酶体酸性环境(pH 4.5~6.0)中被水解切割,利用血浆和细胞质区室之间的pH值差异实现有效载荷选择性释放。然而,pH敏感型连接子通常会面临血浆稳定性不足的挑战,可能导致药物在到达靶点之前过早释放,因而其应用受到一定限制。
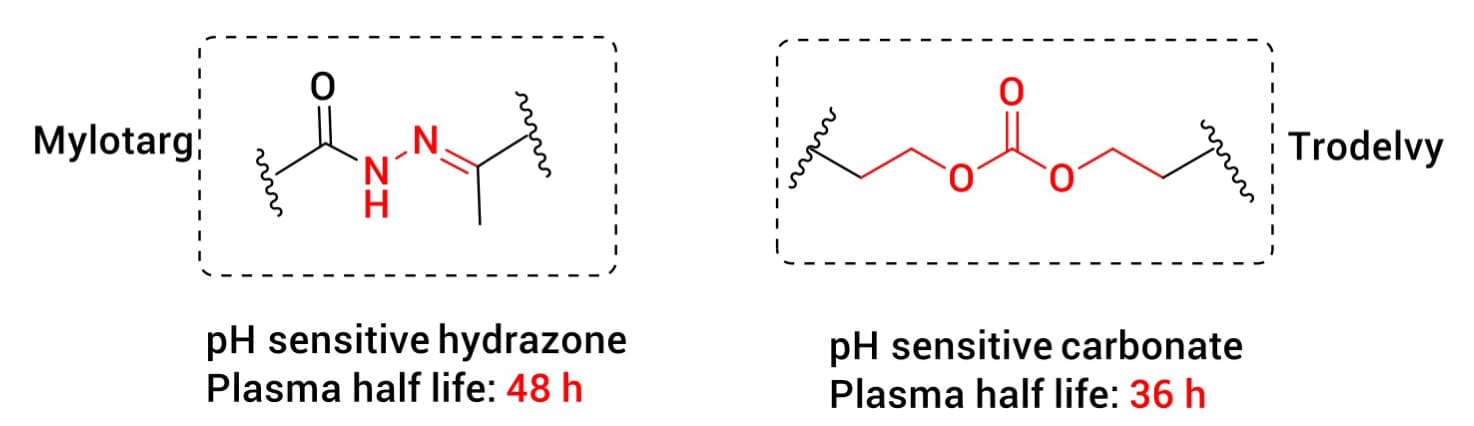
图3. 酸可裂解连接子[1]
二硫键是ADC药物设计中另一类重要的可切割连接子(图4)。目前共有三款已上市ADC(Mylotarg、Besponsa和Elahere)使用了该设计。其切割依赖于GSH浓度差异:体内血浆GSH浓度为2-20 μmol/L,而细胞内浓度可达1-10 mmol/L,且肿瘤细胞GSH水平通常更高。这种差异使二硫键在血液循环中保持相对稳定,而在肿瘤细胞内被高浓度GSH还原切割。此外,最佳二硫键设计需要精细平衡血浆稳定性与细胞内切割效率。研究表明,通过在二硫键相邻碳原子上引入甲基取代基来增加空间位阻,可以增加血浆稳定性,但取代基不宜过多,在适中的取代基空间位阻下,ADC抗肿瘤活性最佳[3]。
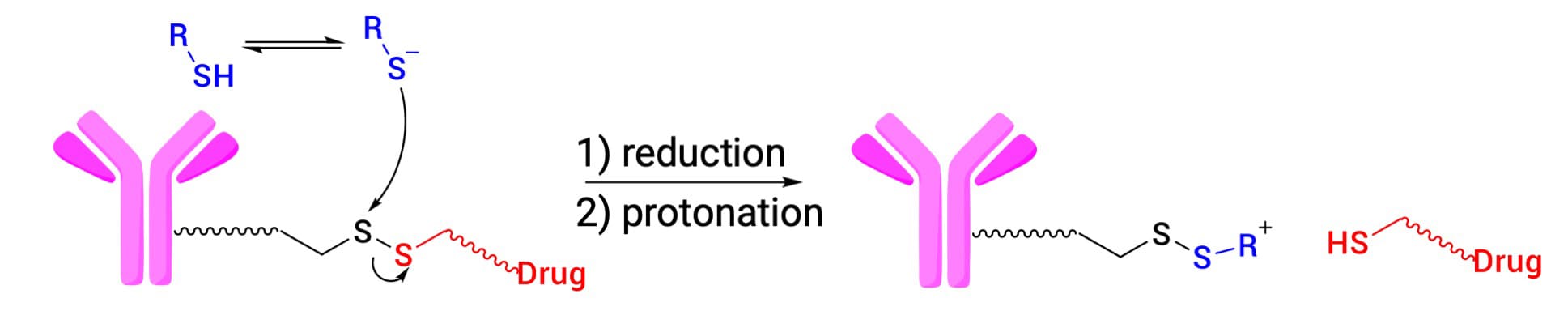
图4. 二硫键连接子还原裂解[3]
酶可切割连接子
与化学可切割连接子不同,酶可切割连接子利用肿瘤细胞高表达的蛋白酶实现选择性药物释放。其中,缬氨酸-瓜氨酸(VCit)是目前已获批ADC中应用较多的酶切单元,其设计主要是基于溶酶体蛋白酶对瓜氨酸与对氨基甲酸苄酯(PABC)之间酰胺键的选择性水解(图5)。
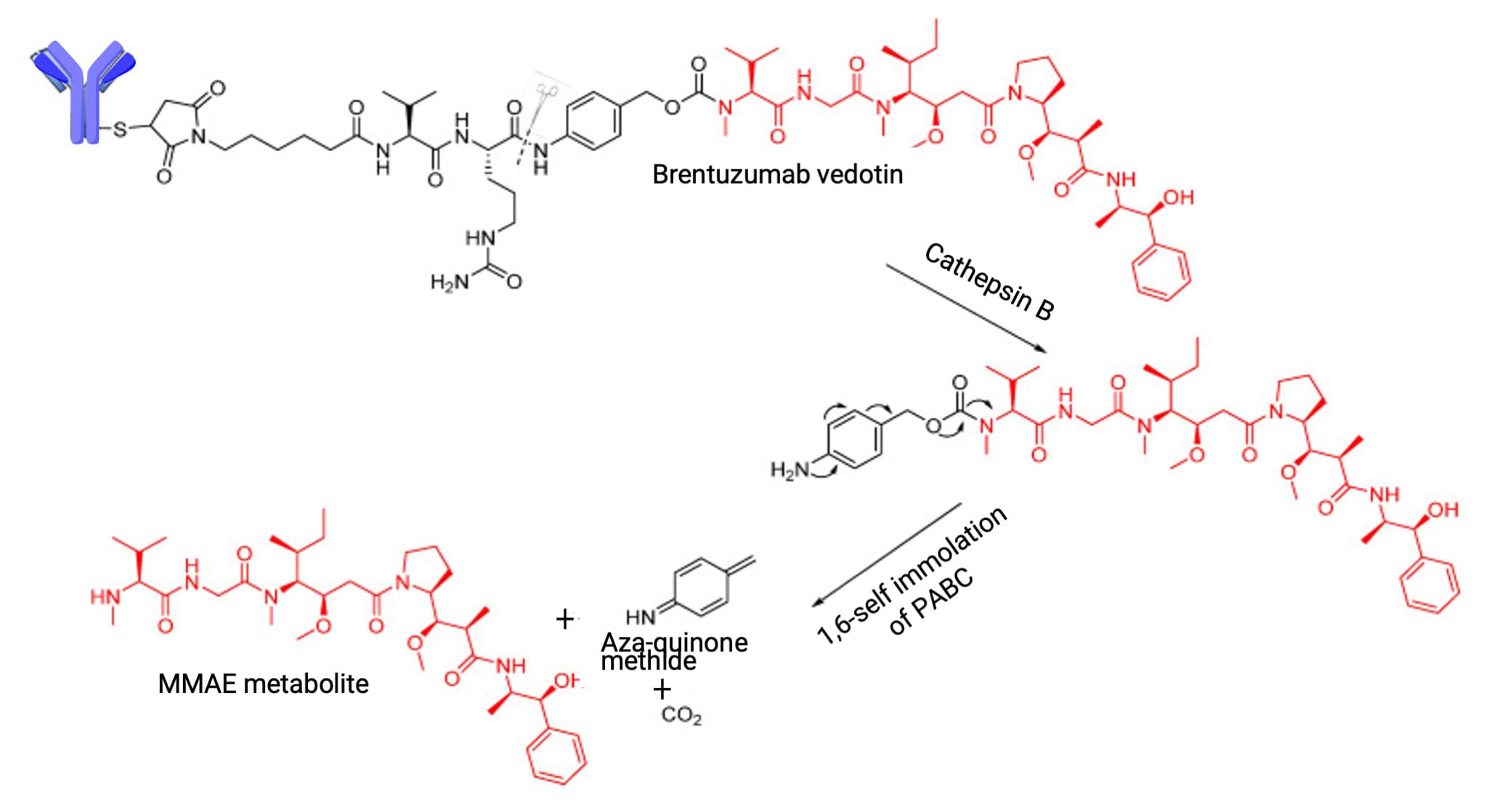
图5. 溶酶体蛋白酶切割缬氨酸-瓜氨酸(VCit)释放有效载荷[4]
然而,研究发现含VCit连接子的ADC体外血浆稳定性存在种属差异:与人和猴血浆相比,其在小鼠血浆中的稳定性显著降低。这主要归因于小鼠血浆中羧酸酯酶(Ces1c)介导的连接子水解,因而不利于以小鼠作为药效模型的临床前评估。为解决这一问题[5],研究人员通过在缬氨酸的N端(P3位置)引入酸性氨基酸,构建了谷氨酸-缬氨酸-瓜氨酸连接子(EVCit)(图6b)。实验表明:两种连接子偶联的ADC与人肝组织蛋白酶共孵育,半衰期分别为4.6 h(VCit)和2.8 h(EVCit);在小鼠血浆中孵育14天后,含VCit连接子的ADC损失了超过95%的有效载荷,而含EVCit连接子的ADC几乎没有观测到连接子切割。由此可见,EVCit连接子不仅对组织蛋白酶高度敏感,且在小鼠血浆中高度稳定,具有更强的抵抗Ces1c酶解能力。
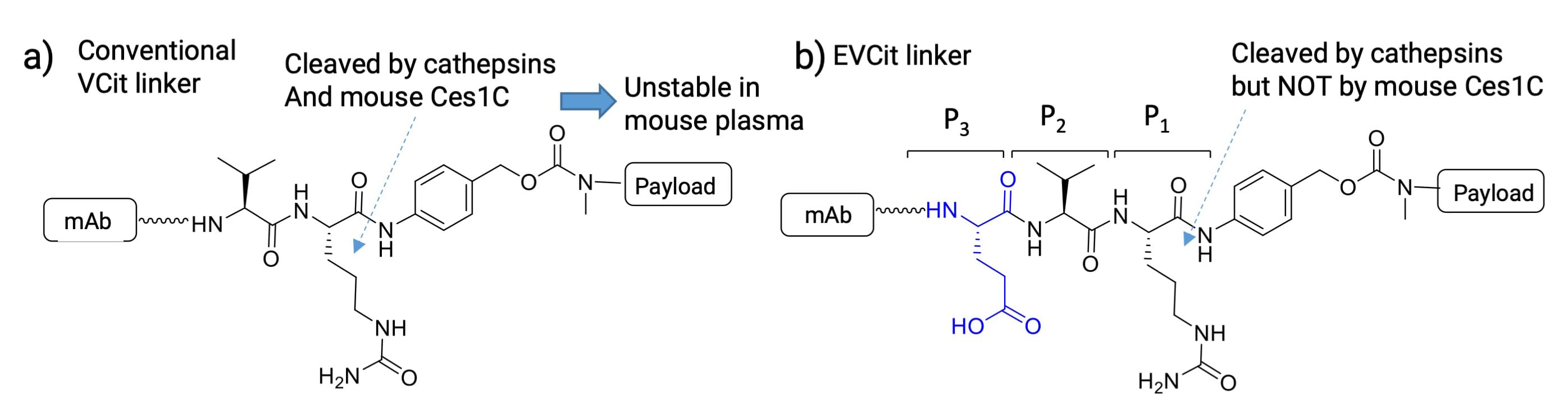
图6. a) VCit连接子和b) EVCit连接子结构[5]
此外,中性粒细胞弹性蛋白酶也可以切割VCit连接子,这被认为是临床剂量限制性毒性(中性粒细胞减少症)的潜在原因之一。为解决这一问题,研究人员通过结构优化开发了新型连接子,例如:将P2位置的缬氨酸用甘氨酸替换,构建谷氨酸-甘氨酸-瓜氨酸(EGCit)连接子(图7a),或设计一种非线性结构的外接可切割连接子(Exo-EEVCit)(图7b)。实验表明,基于这两种连接子构建的ADC均能够有效抵抗中性粒细胞弹性蛋白酶水解。
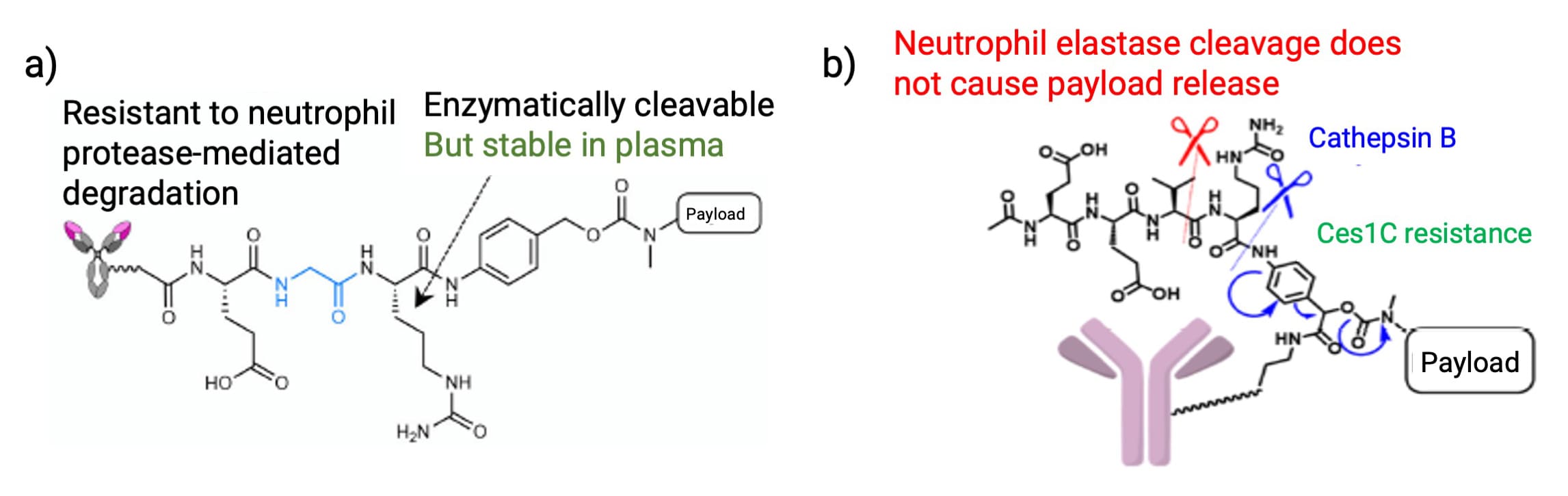
图7. a) EGCit连接子[6]和b) Exo-EEVCit连接子结构[7]
除上述连接子外,其他多种蛋白酶敏感肽序列也被应用于ADC构建,如GGFG、VA、AA和AAN等。此外,还有一些其他类型水解酶介导的连接子裂解,如β-葡萄糖醛酸糖苷酶、β-半乳糖苷酶和磷酸酶等(图8)。对连接子可切割位点的持续探索,旨在获得既能增强循环稳定性又能在肿瘤细胞或微环境中高效裂解的响应单元,最大限度地扩大ADC治疗窗。
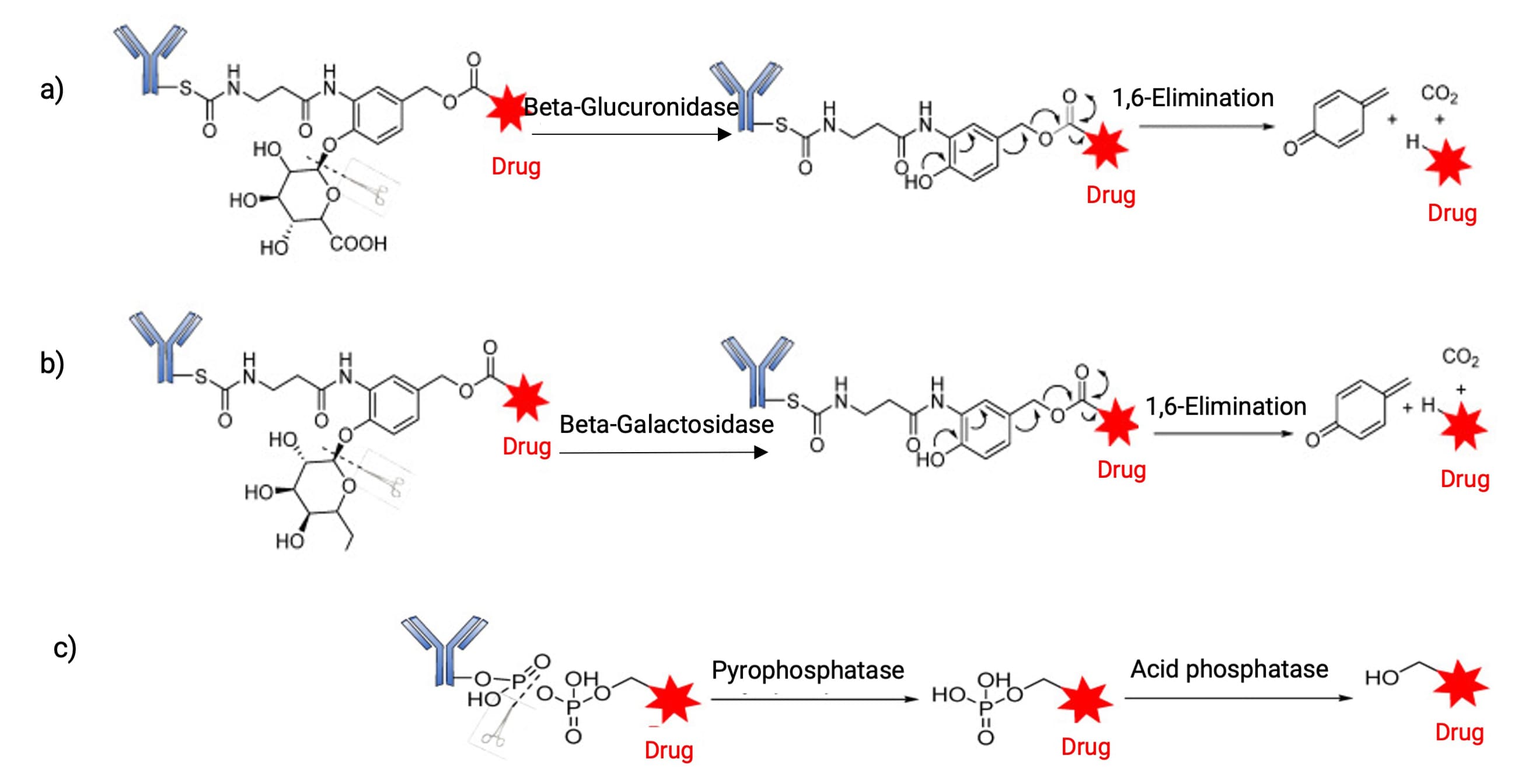
图8. a) β-葡萄糖醛酸糖苷酶、b) β-半乳糖苷酶和 c) 磷酸酶介导的释放[4]
与抗体偶联的官能团设计
与抗体偶联的连接子官能团设计需要兼顾偶联稳定性和DAR值(drug to antibody ratio)均一性,偶联稳定性是影响ADC安全性的关键因素,而均一稳定的DAR值则是保证ADC可重现的药代动力学特征和抗肿瘤疗效的基础。
N-羟基琥珀酰亚胺(NHS)偶联
一些ADC采用N-羟基琥珀酰亚胺(NHS)与抗体上赖氨酸(Lys)残基反应,形成稳定的酰胺键(图9)。抗体中赖氨酸残基数量较多,以IgG1为例,抗体表面约有90个Lys残基,其中约30个可用于偶联修饰,这意味着1到30个有效载荷可以偶联到抗体上,其DAR值异质性可想而知。不过,也有研究表明,当生产条件保持恒定时,多个批次中的ADC偶联位点分布一致,这种可重复的位点占用可以支持ADC大规模生产。
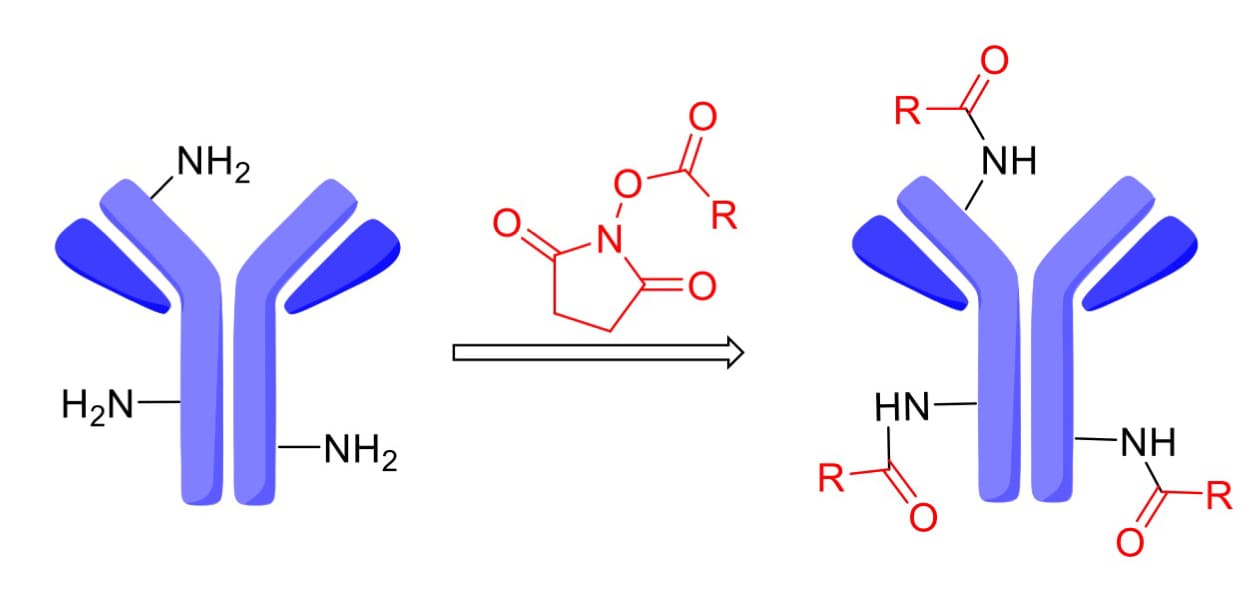
图9. N-羟基琥珀酰亚胺(NHS)与抗体上赖氨酸残基偶联[4]
马来酰亚胺偶联
马来酰亚胺(MC)与抗体的半胱氨酸(Cys)偶联是目前广泛应用的策略(图10)。半胱氨酸在抗体中主要以二硫键的形式存在,在还原条件下,如反应体系中加入三(2-羧乙基)膦(TECP)或二硫苏糖醇(DTT),暴露出硫醇基团,并与马来酰亚胺(双键)发生迈克尔加成,将有效载荷共价偶联在抗体上。链间二硫键可提供8个确定的偶联位点,从而显著降低抗体偶联药物的DAR值异质性。
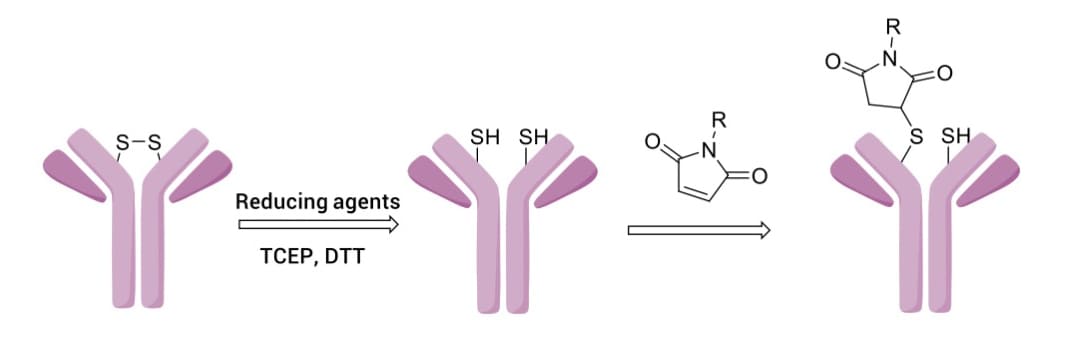
图10. 马来酰亚胺与抗体链间半胱氨酸(由二硫键还原产生)偶联产生硫代琥珀酰亚胺[4]
然而,马来酰亚胺偶联的ADC容易在血液循环中发生逆迈克尔加成而过早释放有效载荷。研究表明[8],使用马来酰亚胺偶联的ADC(DAR=8)与人血浆共孵育168 h后平均DAR值降为3,DAR值变化主要归因于逆迈克尔加成。另外,也有研究表明[9],将马来酰亚胺偶联的ADC在人血浆中孵育96 h,检测到Albumin-MC-vc-MMAE结合物;若在人血浆中加入过量Cys或GSH,共孵育24 h后可检测到Cys-MC-vc-MMAE或GSH-MC-vc-MMAE结合物。这表明解偶联产生的马来酰亚胺可能与血浆中的白蛋白、Cys或GSH发生快速结合(图11a)。此外,实验人员将Albumin-MC-vc-MMAE与过量Cys在人血浆中共孵育24 h,发现前者完全转化为Cys-MC-vc-MMAE,说明两者之间的马来酰亚胺交换具有浓度依赖性(图11b)。
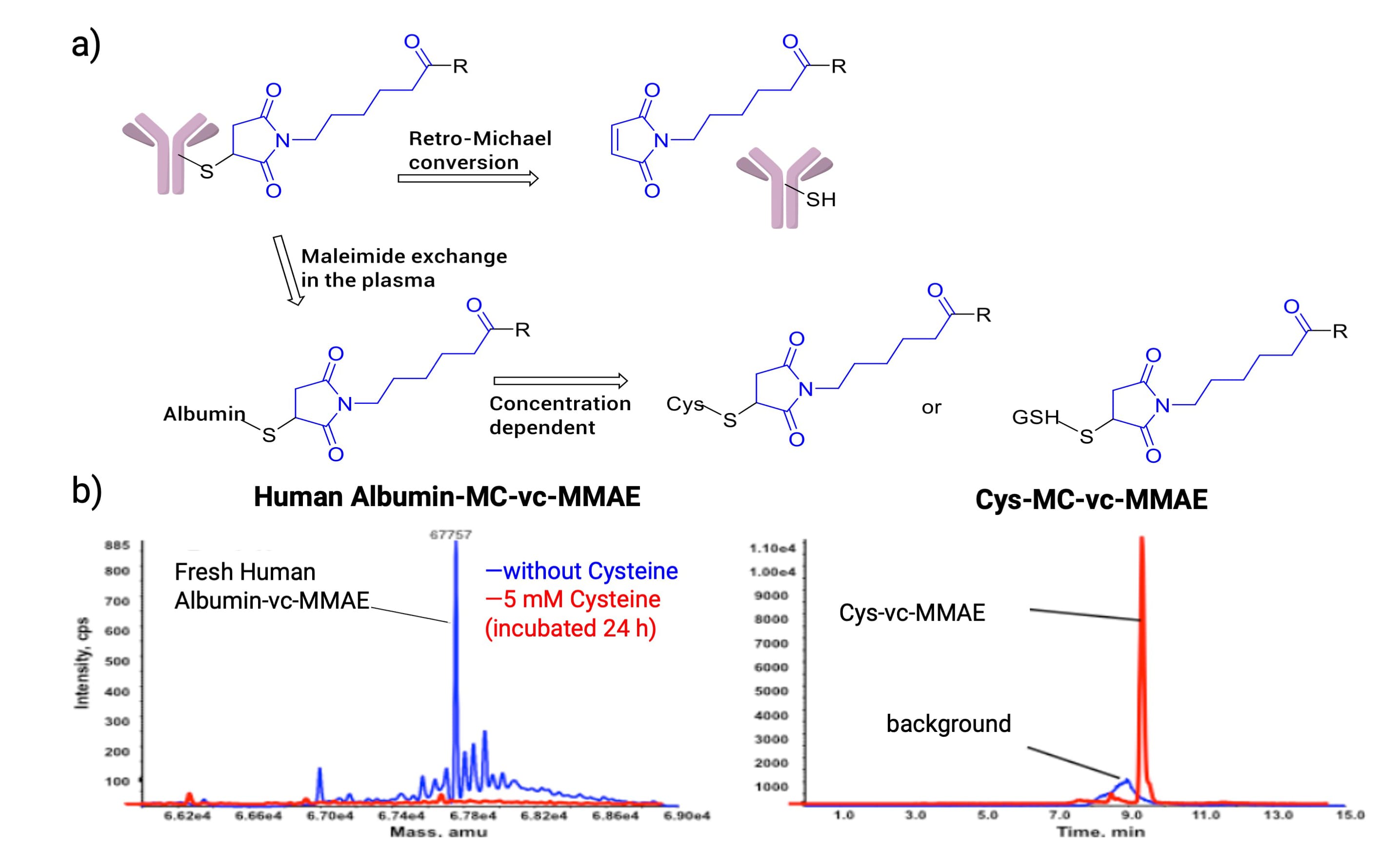
图11. a) 马来酰亚胺偶联的ADC在血浆中发生逆迈克尔加成,并与Albumin、Cys或GSH发生马来酰亚胺交换;b) Albumin-MC-vc-MMAE在人血浆中与过量Cys共孵育24h后,完全转化为Cys-MC-vc-MMAE[9]
研究还发现,一旦马来酰亚胺偶联产生的硫代琥珀酰亚胺产物发生开环水解,连接子与抗体之间的硫醚键将趋于稳定,基于此,一些改进的马来酰亚胺连接子被设计出来,如在偶联基团附近引入碱性氨基构建自稳定马来酰亚胺(mDPR,图12),促进硫代琥珀酰亚胺快速开环水解以提高ADC血浆稳定性。
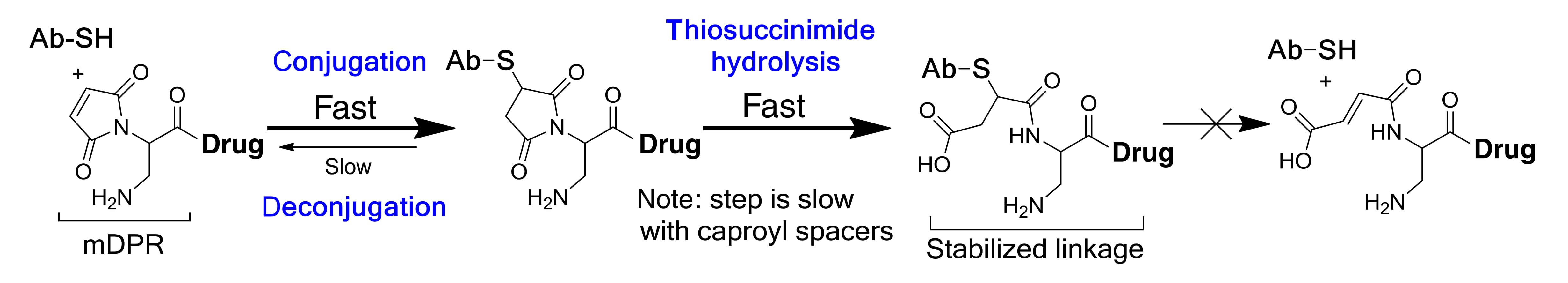
图12. 自稳定马来酰亚胺(mDPR)开环水解[10]
为进一步提升ADC稳定性并降低异质性,酶促连接(如转谷氨酰胺酶介导的偶联,图13a)、点击化学(如环辛炔接头与抗体上叠氮基团发生环加成,图13b)等策略逐渐被应用于连接子与抗体之间的偶联反应,以制备具有明确DAR值且稳定均一的ADC。
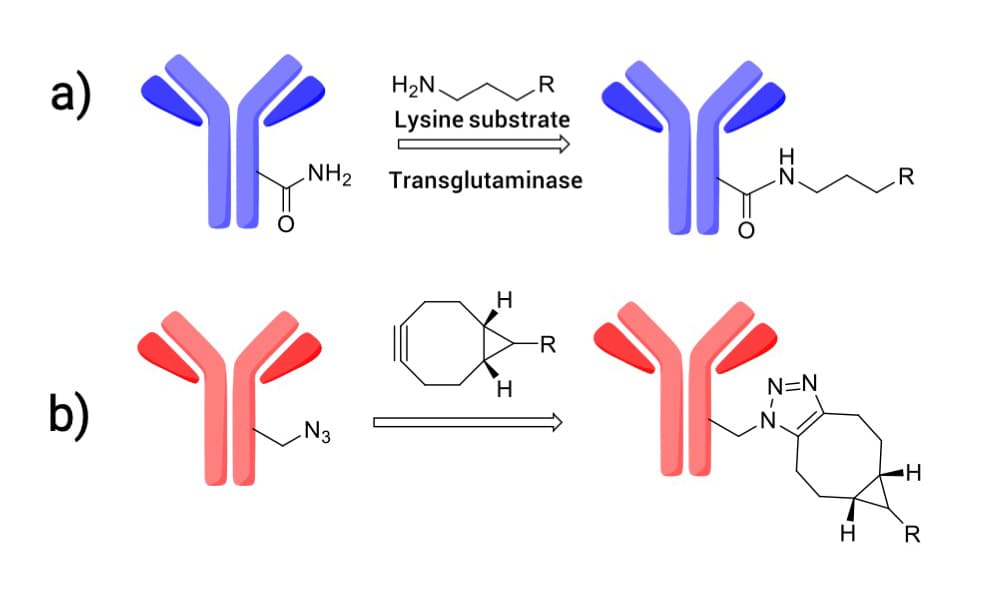
图13. a) 转谷氨酰胺酶催化的抗体谷氨酰胺残基与赖氨酸接头偶联; b) 抗体上叠氮基团与环辛炔接头偶联
ADC连接子的自消除间隔区
有效载荷具有一定的空间位阻,将酶可切割位点与有效载荷直接相连通常不利于有效载荷释放。在有效载荷和酶切割位点之间添加自消除结构,可以降低有效载荷空间位阻对酶识别和切割的不利影响。对氨基甲酸苄酯(PABC)是目前广泛使用的一种自消除结构(图14),常与有效载荷和肽连接子一起使用。其作用不仅在于促进组织蛋白酶识别和结合酶切位点,还能在酶切后通过1,6-消除等机制释放未修饰的有效载荷。
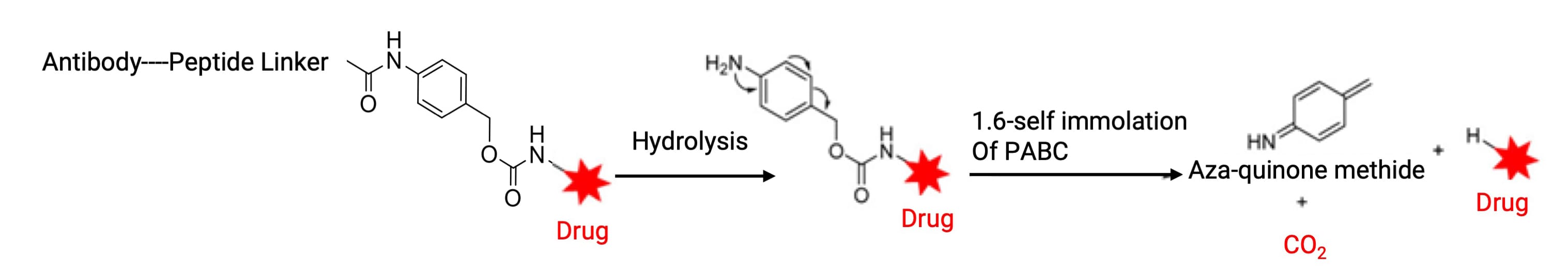
图14. 对氨基甲酸苄酯(PABC)自消除[4]
PABC自消除结构要求有效载荷具有氮附着位点以形成氨基甲酸酯。虽然通过有机合成可以引入氨基,但这可能会对ADC药理活性产生不利影响。氨基甲氧基(AM)是另一种很好的选择,用于连接含醇官能团的药物。已上市ADC曲妥珠单抗(Enhertu)即采用了该结构,通过组织蛋白酶切割GGFG与AM之间的酰胺键,触发AM自消除释放游离有效载荷DXd。
ADC连接子的亲水性结构修饰
有效载荷的引入通常会增加ADC整体疏水性,这可能会导致ADC聚集、血浆清除加速和体内活性不佳。对于高DAR值ADC,有效载荷疏水性带来的影响更加明显。平衡有效载荷疏水性比较有效的方法是在连接子中引入亲水性基团。
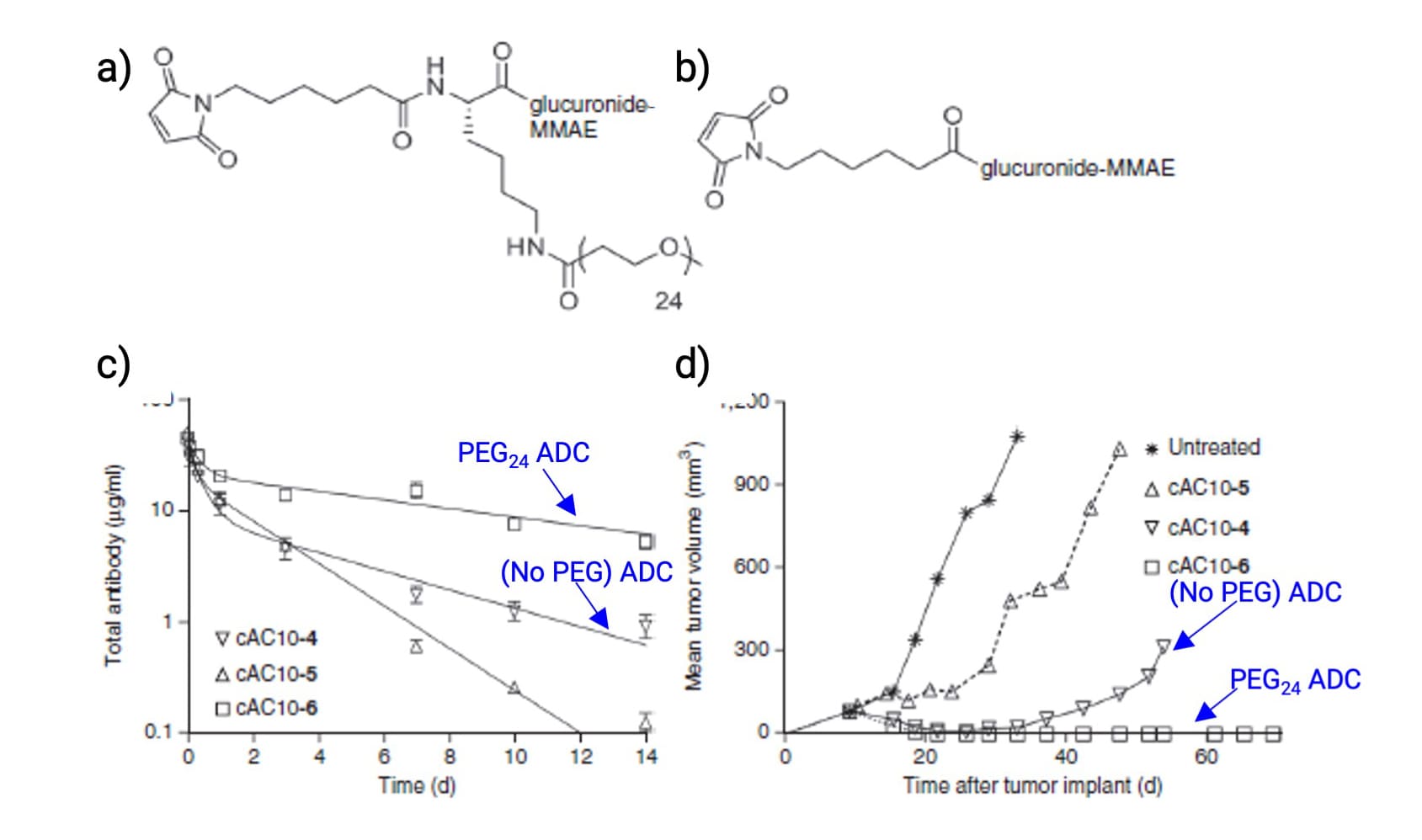
图15. a) 带有PEG24支链的ADC;b) 不带PEG链的ADC;c) 在大鼠血浆中ADC(DAR=8)药代动力学考察; d) ADC(DAR=8)在荷瘤小鼠体内抗肿瘤活性评估[11]
聚乙二醇(PEG)因其良好的水溶性、低免疫原性和体内安全性,已被应用于多款ADC(如Trodelvy和Zynlonta)。研究发现,相比于不含PEG链,带有PEG24支链的ADC疏水性更低,血浆清除更慢,在体内抗肿瘤活性更优(图15)。进一步研究发现,PEG链长对ADC药代动力学具有一定影响(图16):其血浆暴露随PEG链长的增长而增加,至PEG8时已接近裸抗水平,继续增加PEG链长对暴露量贡献明显变小;此外,携带PEG8或更长PEG链的ADC清除率相近,而链长小于PEG8或缺乏PEG的ADC清除显著加快。这些研究表明,适当的PEG链长能够有效降低ADC疏水性,改善药代动力学行为。除PEG之外,环糊精、聚肌氨酸等亲水性结构也被用于修饰连接子,以降低有效载荷疏水性带来的不利影响。
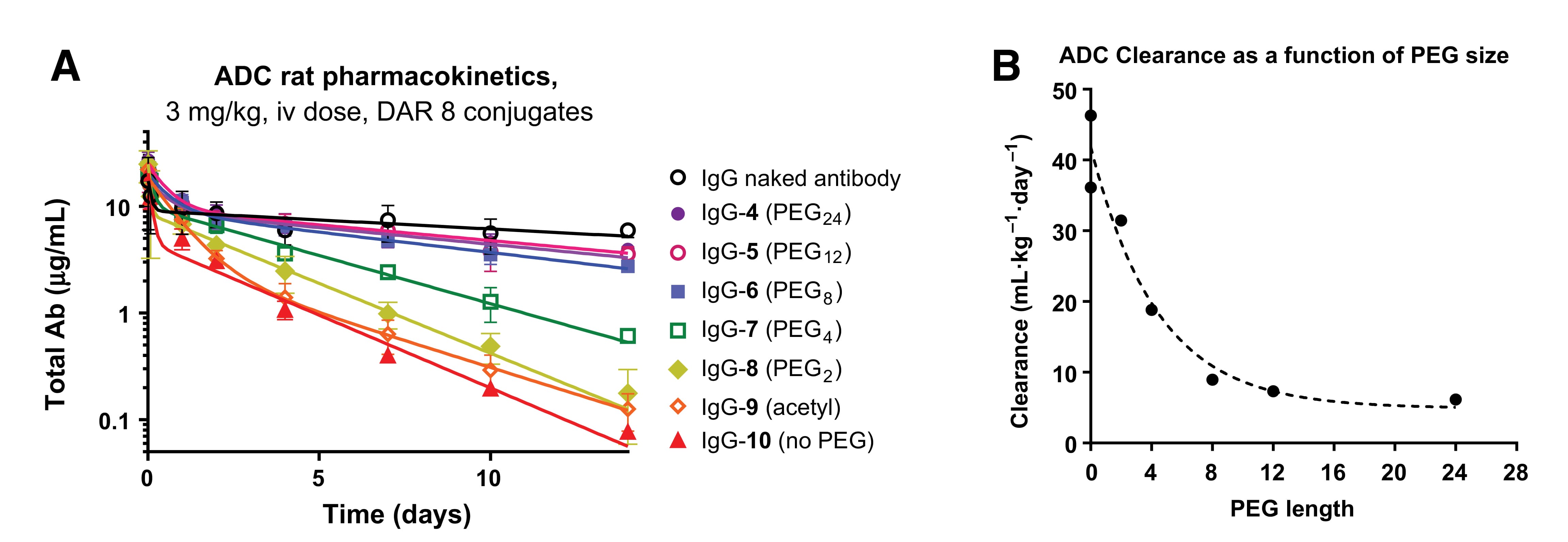
图16. PEG链长对ADC药代动力学影响 [10]
DMPK体外评估方法
理想的连接子应能够让ADC在血液中保持高度稳定。采用体外血浆/全血模型开展稳定性评估,可量化连接子/ADC靶点外过早裂解程度,有助于通过连接子优化减少脱靶释放。除稳定性考察外,连接子优化还需考察靶细胞内的有效载荷释放。靶细胞模型(如抗原高表达的肿瘤细胞)是评估有效载荷释放的直接方法,通过将不同连接子构建的ADC与靶细胞共孵育,可评估连接子/ADC靶细胞内释放有效载荷的能力。
考虑到靶细胞模型通量有限,常使用溶酶体和S9作为评估有效载荷释放的替代模型,溶酶体和S9已被证明可用于早期筛选阶段对新型连接子的高通量筛选。为系统评估连接子性能,我们整合了核心体外研究体系,如表2所示。
表2. DMPK体外核心评估体系
研究体系 | 检测目标 | 特点 |
血浆/全血 | 有效载荷检测及相关代谢物鉴定、DAR值分析等 | • 含纤溶酶等水解酶 • 稳定性考察 • 高通量 |
溶酶体/S9 | • 酶浓度高 • 考察有效载荷释放 • 高通量 | |
肿瘤细胞 | • 酶种类广泛 • 考察有效载荷释放 • 低通量 |
需要注意的是,对于新型连接子,实际代谢位点(切割位点)可能与设计位点不同,仅量化有效载荷不足以全面反应连接子稳定性和有效载荷释放。因此,在ADC连接子优化过程中,若以连接子-有效载荷作为测试物,除检测有效载荷外,还需关注相关副产物,例如:连接子片段-有效载荷产物(连接子不完全脱落)及有效载荷进一步酶代谢产物等;若将连接子-有效载荷与抗体偶联,以完整的ADC结构作为测试物,还需关注抗体水解和抗体脱偶联后Cys结合等有效载荷相关产物。
对于含游离马来酰亚胺基团的连接子-有效载荷,建议使用N-乙酰半胱氨酸(NAC)封闭其活性位点,再开展后续孵育实验,以减少马来酰亚胺对半胱氨酸蛋白酶(如组织蛋白酶)酶活的影响,避免因酶活抑制导致假阴性结果。对于马来酰亚胺偶联的ADC,其在血浆/全血中容易与白蛋白发生马来酰亚胺交换,这部分脱落的有效载荷难以通过常规小分子分析方法进行检测,因此需结合DAR值分布与变化来综合评价体外稳定性。通过DAR分析、有效载荷检测及相关产物鉴定,可系统反映ADC在血液循环中的稳定性,为连接子设计与优化提供数据支持。
结语
抗体的精准靶向性与小分子药物的高效杀伤力使得ADC在肿瘤治疗领域占据前沿地位。连接子作为影响ADC疗效和安全性的关键因素,其合理设计对提升治疗指数至关重要。当前新型连接子研发已在降低脱靶毒性、提高循环系统稳定性及扩大治疗窗等关键问题上取得一定进展。然而,连接子选择尚无通用原则,需根据抗体特性、载荷性质和靶点特征,以及连接子稳定性、有效载荷释放特点与ADC整体治疗效果进行综合权衡,以确定最合适的连接子设计。
药明康德DMPK整合先进仪器平台与专业团队,建立了涵盖体外稳定性评估(血浆/全血)、有效载荷释放评估(溶酶体/S9/肿瘤细胞模型等)及体内(荷瘤/健康动物)药代动力学研究的完整评估体系,可提供有效载荷检测、相关产物鉴定、DAR分析及ADC药代动力学分析等多方位服务,为连接子优化和创新ADC开发提供强有力的技术支撑。
作者:王慧娟、李瑞兴、曹卫群、施立琦、程起干
编辑:富罗娜·克里木、钱卉娟
设计:张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系
参考
[1] Su Z, Xiao D, Xie F, et al. Antibody–drug conjugates: Recent advances in linker chemistry[J]. Acta Pharmaceutica Sinica B, 2021, 11(12): 3889-3907.
[2] Yang L, Ma J, Liu B, et al. Recent Advances in Peptide Linkers of Antibody–Drug Conjugates[J]. Journal of Medicinal Chemistry, 2025, 68(17): 18099-18113.
[3] Bargh J D, Isidro-Llobet A, Parker J S, et al. Cleavable linkers in antibody–drug conjugates[J]. Chemical Society Reviews, 2019, 48(16): 4361-4374.
[4] Sheyi R, de la Torre BG, Albericio F. Linkers: An Assurance for Controlled Delivery of Antibody-Drug Conjugate. Pharmaceutics. 2022; 14(2):396.
[5] Anami Y, Yamazaki C M, Xiong W, et al. Glutamic acid–valine–citrulline linkers ensure stability and efficacy of antibody–drug conjugates in mice[J]. Nature communications, 2018, 9(1): 2512.
[6] Ha S Y Y, Anami Y, Yamazaki C M, et al. An enzymatically cleavable tripeptide linker for maximizing the therapeutic index of antibody–drug conjugates[J]. Molecular cancer therapeutics, 2022, 21(9): 1449-1461.
[7] Watanabe T, Fujii T, Matsuda Y. Exo-Cleavable Linkers: Enhancing Stability and Therapeutic Efficacy in Antibody-Drug Conjugates[J]. Journal of Synthetic Organic Chemistry, Japan, 2024, 82(11): 1117-1124.
[8] Li Z, Zhang J, Wu Y, et al. Integrated strategy for biotransformation of antibody drug conjugates and multidimensional interpretation via high resolution mass spectrometry[J]. Drug Metabolism and Disposition, 2025: 100081.
[9] Shen B Q, Xu K, Liu L, et al. Conjugation site modulates the in vivo stability and therapeutic activity of antibody-drug conjugates[J]. Nature biotechnology, 2012, 30(2): 184-189.
[10] Burke P J, Hamilton J Z, Jeffrey S C, et al. Optimization of a PEGylated glucuronide-monomethylauristatin E linker for antibody–drug conjugates[J]. Molecular Cancer Therapeutics, 2017, 16(1): 116-123.
[11] Lyon R P, Bovee T D, Doronina S O, et al. Reducing hydrophobicity of homogeneous antibody-drug conjugates improves pharmacokinetics and therapeutic index[J]. Nature biotechnology, 2015, 33(7): 733-735.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息




















