药物代谢是许多药物清除的重要途径,代谢酶在其中发挥了重要的作用。代谢反应类型主要包括氧化、还原、水解和结合反应,氧化反应是最常见的代谢途径,其中CYP450酶系参与了约75%的代谢反应[1],研究比较广泛。但在一些特殊情况下,非P450酶参与的氧化代谢可能造成严重的后果,需要引起重视。本文将从一些非P450氧化酶被忽视的案例出发,介绍一些常见的非P450氧化酶及如何进行识别和验证,从而帮助更好地推进药物研发。
一、被忽视的非P450氧化酶
非P450氧化酶由于参与代谢占比较低,关注较少,常规情况下候选药物在临床前不进行专门的表型鉴定,然而某些候选药物临床阶段却出现了不可预见的后果,导致其研发过程被迫终止。
如化合物A,临床前实验采用大鼠和犬作为毒理种属进行研究,未出现安全性问题,但一期临床试验中,药物还没有到达治疗剂量就已经发生严重的肾毒性,补充的临床前研究发现由非P450氧化酶催化产生的代谢产物M3在兔肾小管产生不溶性晶体沉淀,是产生肾毒性的原因。
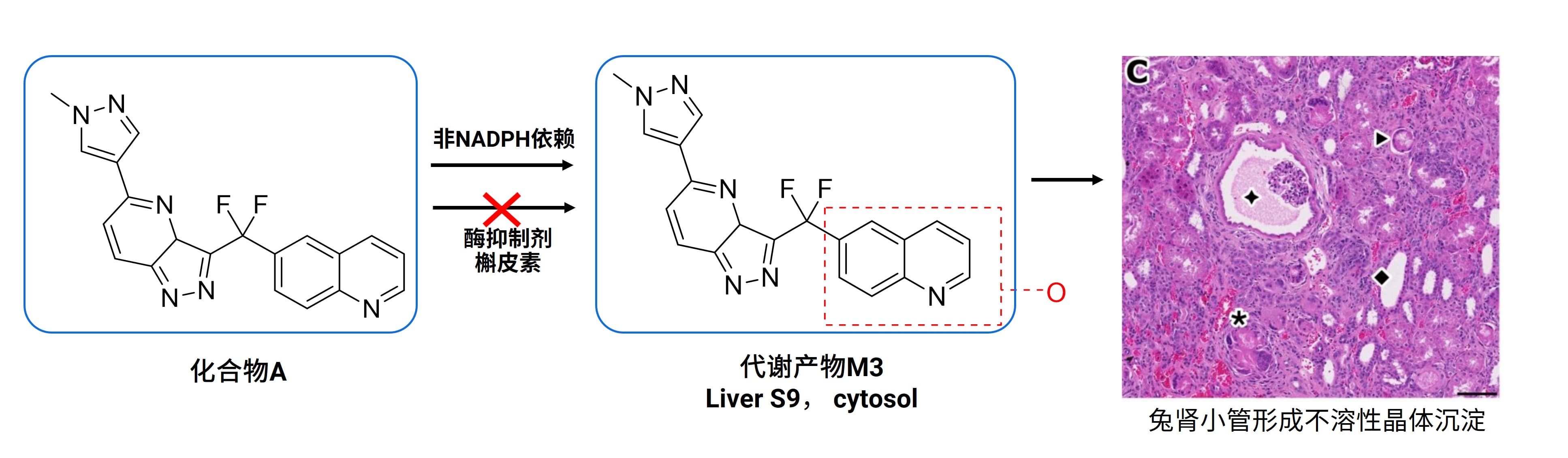
图1: 非P450酶产物导致化合物A肾毒性(图片来源[2])
这样的情况并非个例,表1汇总了一系列由非P450氧化酶参与代谢导致不良后果而终止研究的药物。这些药物临床试验中表现出了引起肾毒性、口服生物利用度低、高清除率、半衰期短等问题。结合这些项目的临床前试验,可以发现其普遍缺少肝细胞代谢产物鉴定结果,或存在体内实验动物种属选择不佳等问题。由于前期研究中没有对非P450氧化酶有效地识别其特性,将其与P450氧化酶进行区分,所以在临床前实验中需要提高对非P450氧化酶的重视。
表1: 非P450酶参与代谢导致临床试验终止(图表来源[3-4])
药物 | 结构 | 临床前实验 | 临床结果 |
Carbazeran |  | Dog PK | 口服 F < 5% |
BIBX1382 |
| LM; Mouse, rat, dog PK | 口服 F = 5% |
Zoniporide |
| Multiple species PK | 高清除率 |
RO1 |  | Rat, dog, monkey PK | 半衰期<1h |
SGX523 |
| LM; Rat, dog PK | 肾毒性 |
二、常见非P450氧化酶分类及特点
常见的非P450氧化酶包括:黄素单加氧酶(FMO)、单胺氧化酶(MAO)、醛氧化酶(AO)、黄嘌呤氧化酶(XO)等。表2列举了各种非P450酶在生物体内表达的位置和常见的亚型。
表2: 常见的非P450氧化酶表达位置及亚型(图表来源[1])
酶 | 存在位置 | 亚型 |
黄素单氧化酶 (FMO) | 微粒体 | FMO1、FMO2、FMO3、 FMO4、FMO5 |
单胺氧化酶 (MAO) | 线粒体外膜 脑、肝、胎盘 | MAO-A MAO-B |
醛氧化酶 (AO) | 胞浆 肝、肾 | AOX1、AOX3、 AOX4、AOX3l1 |
黄嘌呤氧化酶 (XO) | 胞浆 小肠 | NA |
乙醇脱氢酶 (ADH) | 胞浆 肝脏 | ADH1、ADH2、ADH3、 ADH4、ADH5 |
乙醛脱氢酶 (ALDH) | 线粒体、胞浆 | 17种 ALDH2(酒精过敏) |
如表2所示,黄素单加氧酶(FMO)包含五种亚型,其中FMO3和FMO5在成年人肝脏中高表达,是药物代谢方面最重要的两种FMO酶亚型。FMO酶与CYP450酶类似,存在于肝微粒体中,是一种NADPH依赖性氧化酶。当药物主要由肝微粒体氧化代谢时,需要区分是哪种酶的作用。单胺氧化酶(MAO)多见于线粒体外膜中,多存在于脑肝胎盘中,目前只发现了AB两种亚型。除了FMO酶,其他非P450氧化酶多存在于细胞胞浆中,所以肝微粒体孵育实验不能获得除FMO酶以外的其他非P450氧化酶的催化结果[5]。
醛氧化酶(AO)与黄嘌呤氧化酶(XO)两者具有高度同源性。AO酶有明显的种属差异性、地区差异性和个体差异性。人体内只有AOX1表达,AOX1在人和猴体内活性较高,猕猴的肝脏只表达单一表型AOX1,与人类AOX1的同源性超过90%[6],而犬肝内不表达AOX1,因此AO酶参与代谢的药物其体内研究动物种属的选择需要格外重视。AO酶在体内的活性变化大,且被AO酶代谢的药物往往体现出快速清除、低暴露量的特点,若药物的代谢过程由AO酶主导,将对药物的研发提出更多的挑战。所以,应当尽早地识别非P450酶催化对于药物代谢的贡献。关于AO酶的早期预测和应对策略我们也将推出专题文章,请持续关注。
三、非P450氧化酶介导药物代谢的识别和验证
底物类型
由于不同非P450氧化酶催化的底物结构不同,进行非P450氧化酶的研究,首先可以根据化合物的结构进行初步判断。FMO酶具有广泛的底物特异性,能够催化含氮、硫、硒、磷化合物的氧化,以及酮或醛的插氧反应(Baeyer–Villiger)生成内酯;而AO酶主要催化醛类生成羧酸以及O/N杂环邻位C氧化。其他的非P450氧化酶也具有各自的底物特点。当化合物结构中涉及相关特征结构时,需要给予额外的关注。
不同体系的化合物代谢产物区别
除了化合物结构特征外,对于化合物在不同体系中代谢产物不一致的结果也应当引起关注。若肝细胞和微粒体中稳定性结果以及相关氧化产物的生成情况存在较大差异,通常提示有非P450氧化酶参与代谢。此外,由于特定体外实验(如肝微粒体)不能完全模拟体内环境,当化合物体外、体内代谢产物鉴定结果不一致时,也可能是由非P450酶参与催化导致。
非P450氧化酶表型鉴定实验
若推测化合物为非P450氧化酶参与代谢,需要进行酶表型鉴定研究。如图2所示,可根据每种酶的特点、反应类型及产物氧化位点,初步判断是由哪种酶参与。通过使用不同的实验孵育体系及辅酶(Co-factor)、添加抑制剂或诱导剂等,进行重组酶孵育实验进一步确认是哪一种酶亚型。
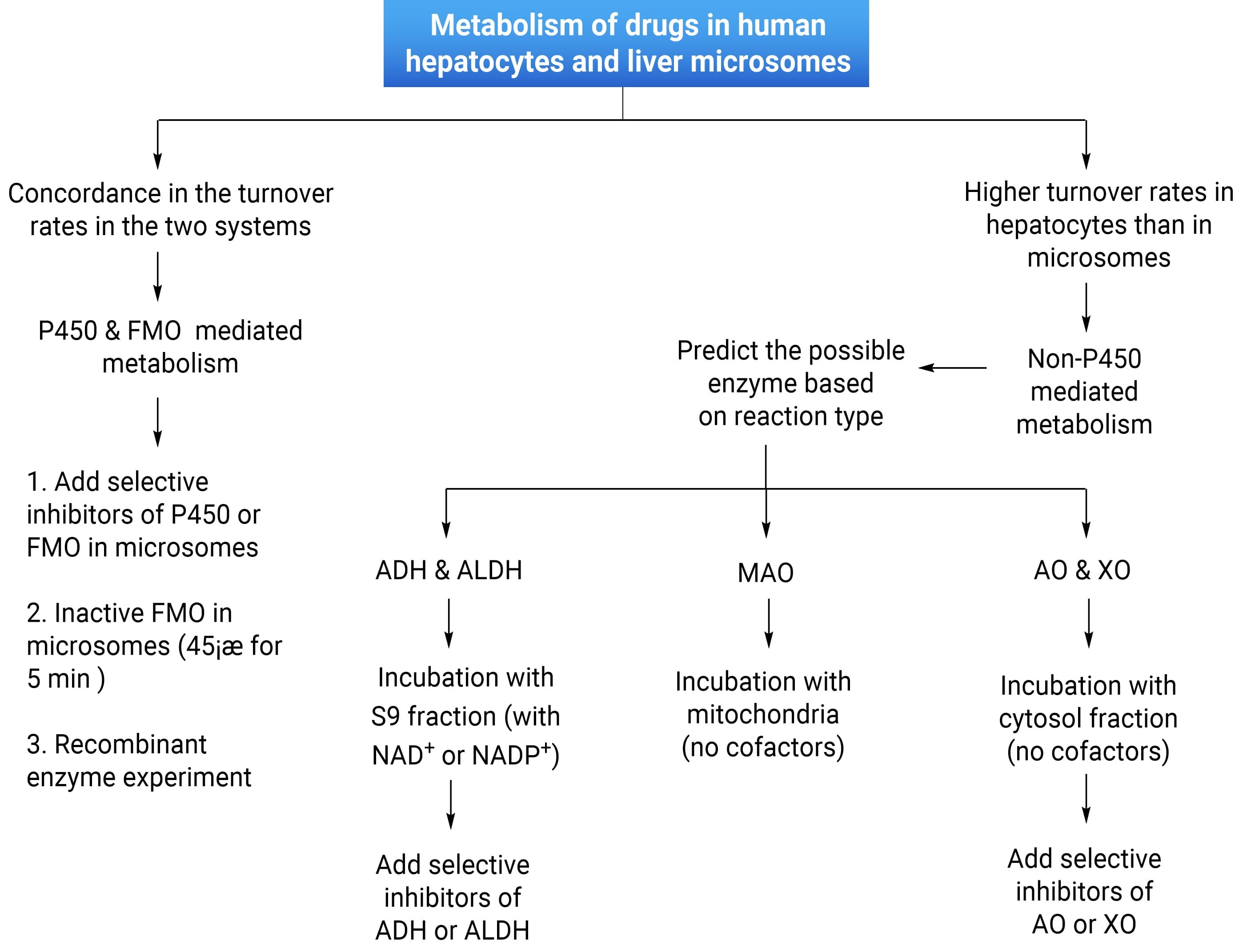
图2: 非P450氧化酶介导药物代谢的识别和验证(图片来源[7])
孵育体系及Co-factor选择
FMO酶是肝微粒体中的非P450氧化酶,是一种热失活型酶,且对于pH值敏感,实验可采用不同的孵育温度和pH条件,以灭活或提高酶活性;其他非P450氧化酶一般在S9、Cytosol中存在,不同的酶代谢所使用的Co-factor不同,例如乙醇脱氢酶(ADH)和乙醛脱氢酶(ALDH)由还原型辅酶Ⅰ(烟酰胺腺嘌呤二核苷酸,NAD)或还原型辅酶Ⅱ(烟酰胺腺嘌呤二核苷酸磷酸,NAD(P)H)参与反应。
抑制剂或诱导剂
特殊的酶抑制剂与诱导剂,可以在酶表型鉴定过程抑制或提高某类酶的活性,辅助我们确认代谢酶的类型。由于诱导剂选择性较差,一般在实验中较少采用;实验中选择高选择性的抑制剂最为理想,如AO酶的抑制剂包括甲萘醌、雌二醇、雷洛昔芬、氯丙嗪 、西咪替丁、喹硫平、美沙酮、肼屈嗪等,其中肼屈嗪的选择性较高,雷洛昔芬的抑制能力较强,为常用的AO酶抑制剂。
四、非P450氧化酶参与的药物研究案例
通过以下案例展开描述非P450氧化酶参与的药物研究。
瑞博西尼是诺华公司研发的一种CDK4/6蛋白激酶抑制剂。2017年3月经FDA批准用于乳腺癌的治疗。临床前常规肝微粒体孵育主要代谢产物为M4和M15,临床前大鼠和犬体内ADME研究发现该药物在体内广泛代谢,血浆中占比最高的代谢产物为M13,大鼠AUC血浆M13占比38%。表现出体内体外代谢产物结果不一致,推测M13可能由非P450氧化酶参与代谢。经科学家设计实验,验证了M13是由FMO3介导形成的N-氧化。在临床研究中,人体血浆中的主要代谢产物仍然为M13,AUC占比为9.39%,其余代谢产物占比均小于4%。因此对于瑞博西尼,FMO3是一个至关重要的代谢酶。
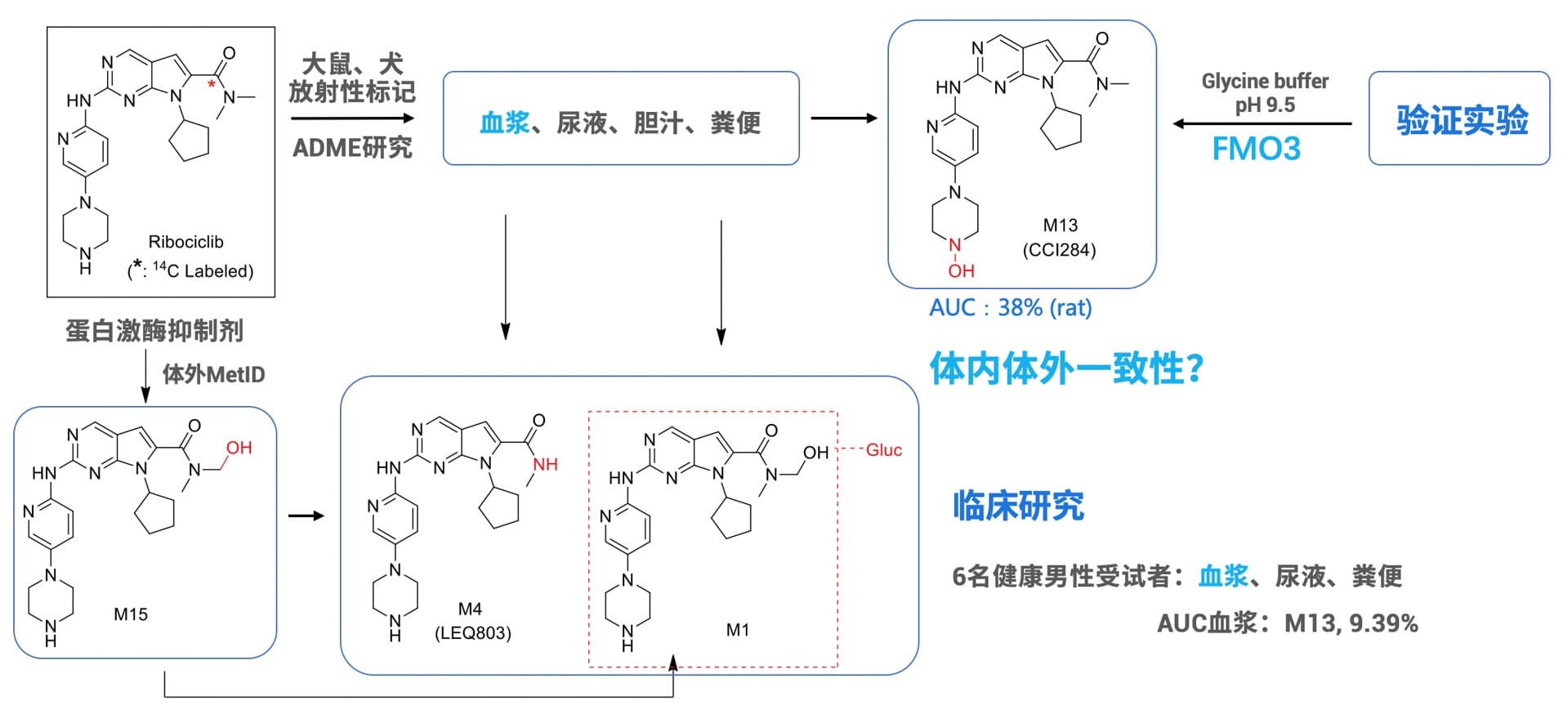
图3: 瑞博西尼代谢产物研究(图片来源[8])
化合物B是一种用于治疗帕金森病的腺苷A1/2双抑制剂,临床前药代动力学研究中肝微粒体代谢稳定性,大鼠和犬体内的绝对生物利用度、总清除率、血药浓度等结果都十分理想。但临床研究中发现,原形药在人体内的血浆浓度暴露量非常低,主要暴露形式为代谢产物M4,化合物B的低暴露及快代谢提示可能是由AO酶催化,这也是体内外不一致的表现。科学家通过孵育人肝细胞加入不同酶抑制剂,发现M4在AO酶抑制剂孵育体系中显著减少,从而确认原形药在人体中的低暴露是由于AO酶催化发生了广泛且快速的氧化代谢。
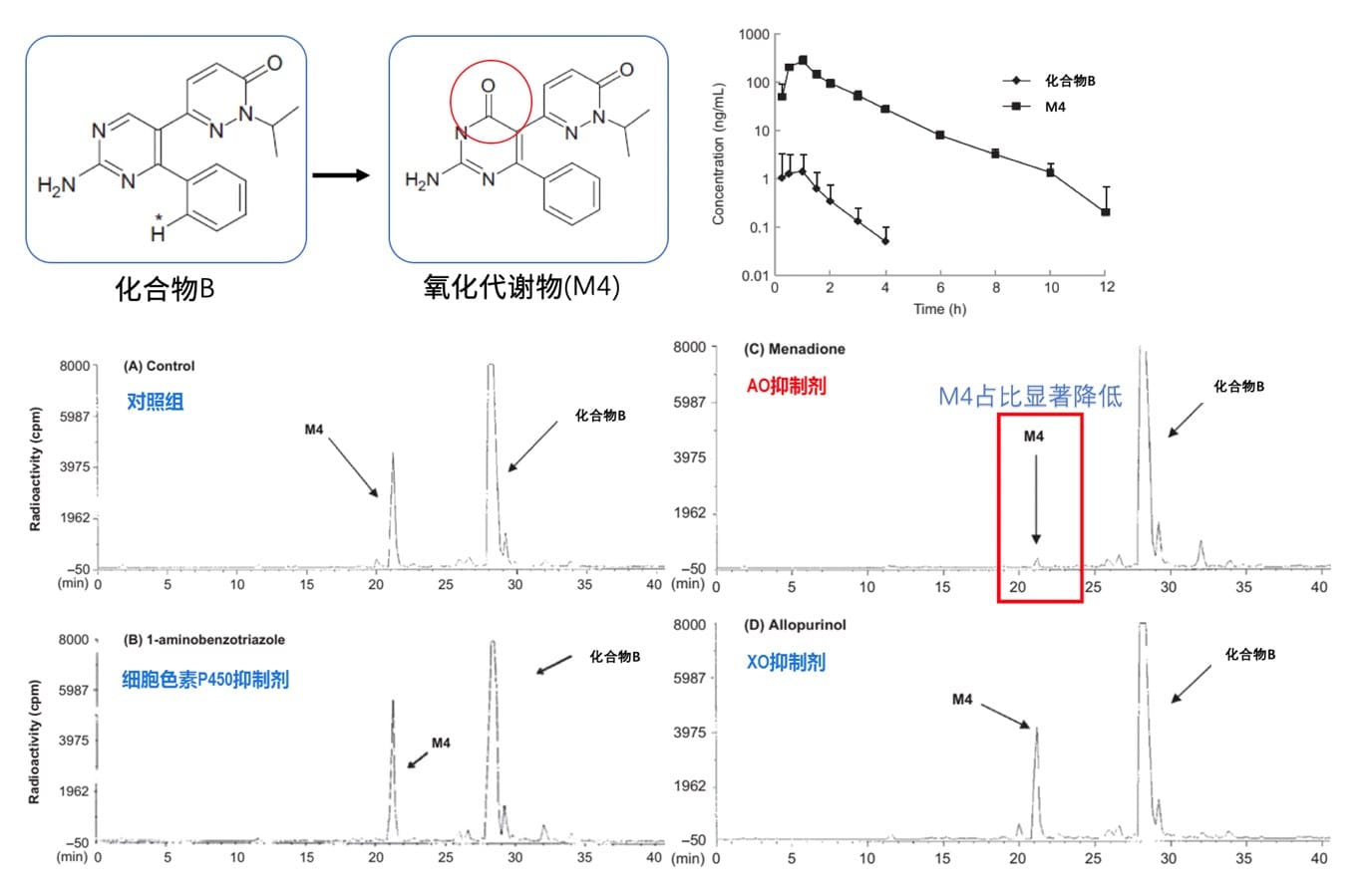
图4: 化合物B代谢酶表型研究(图片来源[9])
针对非P450氧化酶是否参与代谢的识别可以尽早地暴露药物的代谢特性,规避研发失败的风险。而代谢产物鉴定,作为研究体内、体外药物代谢的重要研究方式,能够有效地体现不同实验体系中药物的代谢情况及种属间的差异。通过体外不同孵育体系的结果对比,结合体内体外代谢产物相关性,可以为提示非P450酶参与的代谢反应提供必要的信息。
依托药明康德药物代谢与动力学部完整的酶表型研究平台(CYP、UGT、FMO、MAO、AO和XO),可以在已有代谢产物鉴定结果的基础上,通过对比推测可能参与代谢的酶表型,并引入高选择性的抑制剂,或针对推测的酶亚型开展重组酶孵育的代谢产物鉴定,以评价非P450酶对药物代谢的贡献。
结语
在早期临床前实验中,发现候选药物由非P450酶催化具有重要意义,如果非P450氧化酶在药物代谢中占据特殊贡献,会影响该候选药物开展后续研究的决策。药明康德DMPK一体化的非P450氧化酶表型研究和代谢产物鉴定平台,可以帮助识别和鉴定是否存在非P450酶参与代谢,为选择合适的毒理种属提供依据,规避临床试验风险。避免出现“临床试验失败无法继续推进,一切归零”的后果,同时指导临床试验阶段中对药物相互作用的研究内容。
作者:周欣芸,蔡婷婷,张玲玲,曹卫群
编辑:方健,钱卉娟
设计:倪德伟
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系
参考
[1] 周雷, 钟大放, 陈笑艳. 非P450酶介导的药物氧化代谢研究进展[J]. 药学学报, 2017, 52(1):11.
[2] Lolkema M P, Bohets H H, Arkenau H T, et al. The c-Met Tyrosine Kinase Inhibitor JNJ-38877605 Causes Renal Toxicity through Species-Specific Insoluble Metabolite Formation [J]. Clinical Cancer Research An Official Journal of the American Association for Cancer Research, 2015, 21(10).
[3] Diamond S, Boer J, Maduskuie T P, et al. Species-specific metabolism of SGX523 by aldehyde oxidase and the toxicological implications.[J]. Drug Metabolism & Disposition, 2010, 38(8):1277-1285.
[4] Hutzler J M, et al. Strategies for a comprehensive understanding of metabolism by aldehyde oxidase[J]. Expert Opinion on Drug Metabolism & Toxicology, 2013, 9(2):153-168.
[5] 杨雅坤, 盛莉, 李燕. 黄素单氧化酶在药物代谢和新药研发中的作用[J]. 药学学报, 2017, 052(010):1485-1495.
[6] 刁星星, 陈笑艳. 醛氧化酶在药物代谢中的作用[J]. 宝鸡文理学院学报:自然科学版, 2014, 34(2):13.
[7] Pryde D C, Dalvie D, Hu Q, et al. Aldehyde oxidase: an enzyme of emerging importance in drug discovery [J]. J Med Chem, 2010, 53: 8441-8460.
[8] Alexander D J, Hilmar S, Cyrille M, et al. An integrated assessment of the ADME properties of the CDK4/6 Inhibitor ribociclib utilizing preclinical in vitro, in vivo, and human ADME data[J]. Pharmacology Research & Perspectives, 2020, 8(3).
[9] Akabane T, Tanaka K, Irie M, et al. Case report of extensive metabolism by aldehyde oxidase in humans: pharmacokinetics and metabolite profile of FK3453 in rats, dogs, and humans.[J]. Xenobiotica; the fate of foreign compounds in biological systems, 2011, 41(5):372-84.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息