血浆蛋白结合在药物药代动力学和药效学中起着关键作用,其中,α-1酸性糖蛋白(AAG)对药物在体内分布和清除的影响越来越受到重视。为什么它在药物动力学中如此重要,以及研究者如何深入理解AAG结合在推动新药开发中的重要性?我们的回答如下:
α-1-酸性糖蛋白 (AAG) 是一种主要的血浆蛋白,具有高亲和力和低结合容量的特征。它通过与药物结合来影响药物的生物利用度和分布,从而影响其疗效和安全性。
多个临床案例表明,药物与AAG的结合可能显著影响药物的药代动力学特性。
在研究AAG对药代动力学影响时,有多方面实验因素需要纳入考量。
AAG 是一种主要的血浆蛋白,具有高亲和力和低结合容量的特征。
在血浆中,白蛋白占比约60%,远高于AAG的1-3%,但AAG在药物结合和PK领域仍然扮演着不可或缺的角色。它是急性期蛋白(APP)家族的成员,是一种高度酸性、低等电点的蛋白质。AAG在肝脏中形成,在健康人的血浆中以0.5到1.0mg/mL的浓度循环, 但在多数疾病状态如炎症、感染和癌症条件下,AAG水平能增加2至6倍,这可能影响药物疗效。因此,监测AAG水平对于合理调整药物剂量、预测和评估治疗效果至关重要。AAG对碱性药物有很高的结合亲和力,也可以与中性和酸性药物结合。AAG的生物化学特性使其能够结合多种类型的药物,其糖基化的多样性增加了与药物相互作用的复杂性。这种结构多样性使AAG成为一种能与多种药物相互作用的血浆蛋白,进而影响药物的分布、疗效和毒副作用。
多个临床案例表明,药物与AAG的结合可能显著影响药物的药代动力学特性。
全面了解 AAG的结合特性有助于预测体内的药物行为,从而提高药代动力学/药效学模型的准确性,优化药物剂量、提高疗效并减少早期开发阶段的不良反应。以下案例可以说明研究AAG与药物结合在临床中的意义。
案例1
UCN-01是一种小分子蛋白激酶抑制剂,主要用于肿瘤相关的适应症。在临床实验中,UCN-01显示出与动物实验不一致的PK参数。动物模型中,UCN-01表现出高清除率、高分布容积和中等半衰期,但在人体中实际表现为低清除率、低分布容积和长半衰期。
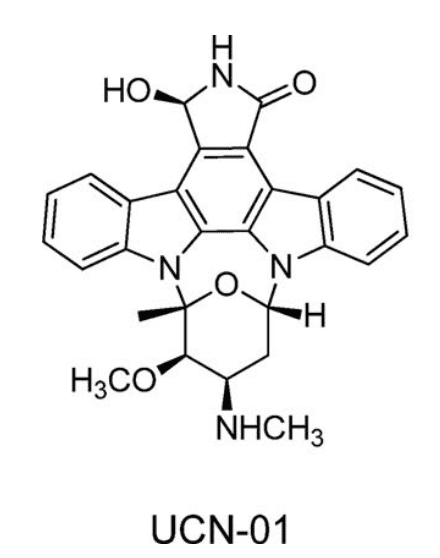
图1. UCN-01 分子式[3]
此外,血浆中UCN-01和蛋白的游离率从动物种属的0.5-1.8%降低到人的0.02%。进一步的蛋白结合研究发现,UCN-01与人血浆AAG之间存在高度特异性的结合,这种特异性结合影响了药物的游离率并随着药物浓度的变化而变化,从而导致了临床的非线性PK。同时,由于人AAG与UCN-01的Kd与临床前物种显著不同,导致异速生长方法的预测准确性非常差。UCN-01与人AAG具有非常缓慢的解离速率,导致分布容积减少,进一步阻碍游离药物与靶标的相互作用[1]。
案例2
Vismodegib是一种治疗转移性基底细胞癌的药物,在I期临床实验中,预期其具有较高清除率和较短的半衰期,但在人体内实际观察到低清除率和长半衰期。此外,单次150mg剂量给药与每日重复150mg剂量间Vismodegib游离率有一定差异,分别是0.25%与0.65%。研究发现,这种差异部分来源于Vismodegib对人类AAG亚型的亲和力高于对大鼠亚型的亲和力。在体外药效实验中,AAG浓度与靶标结合之间存在负相关关系,实验体系中补充生理相关浓度的AAG会导致药效减弱,这表明在Vismodegib药物处置中需充分考虑血浆蛋白结合对药代动力学和药效的影响。在癌症患者的血浆样本中,AAG和总Vismodegib的平均稳态浓度之间有高度相关性,且总Vismodegib浓度随AAG的浓度而对应变化。由于临床PK呈现非线性,Ib期临床实验中评估了Vismodegib维持稳态浓度时的具体给药方案,发现每日一次150mg的给药方式可以保证AAG在被饱和结合后,仍有足够的游离Vismodegib与靶标相互作用以发挥药理作用。此案例体现了深入了解药物与AAG的蛋白结合的重要性,以便更准确地预测和调整药物剂量[1]。
案例3
Imatinib是一种治疗慢性髓性白血病的酪氨酸激酶抑制剂,在患者中表现出线性PK特征。研究表明,Imatinib的PK与ABCB1基因型、体重和AAG水平相关。
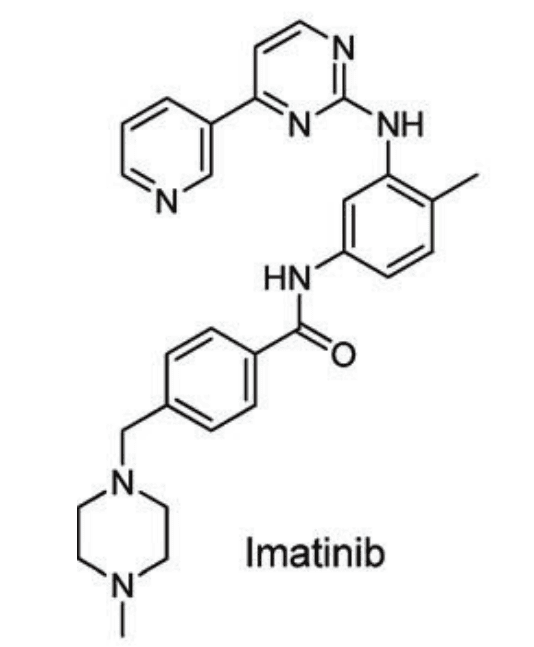
图2. Imatinib 分子式[3]
尽管Imatinib的总血浆浓度表现出线性PK特征,但由于它对AAG具有高亲和力,而对白蛋白的亲和力大约弱55倍,导致游离分数和血浆总浓度之间存在非线性关系。值得注意的是,AAG水平的增加与患者对Imatinib治疗反应减弱或产生药物抵抗现象之间存在一定的关联。同时,还发现增塑剂DEHP对人血浆中Imatinib游离率有较大影响,在体外研究中,当人血浆中添加800μM DEHP时,Imatinib的游离率从3.5%增加到15.3%[1]。
案例4
Alobresib是一种目前处于临床研究阶段的抗肿瘤BET蛋白质抑制剂,其游离率受AAG影响较大。当血浆AAG浓度从0.9mg/mL增加到4.5mg/mL时,Alobresib的游离率下降5倍以上。在晚期癌症患者的血浆中,Alobresib显示出更高的结合,平均游离率为1.48%;而在健康捐献者的血浆中,平均游离率为5.49%。这种差异可能有助于解释晚期癌症患者的血浆PK为何存在较高的个体间变异性,特别是在那些具有较高AAG含量的患者中,他们的血浆药物暴露量非常高[2]。
在研究AAG对药代动力学影响时,有多方面实验因素需要纳入考量。
当存在以下条件时,药物与AAG的结合具有重要的临床意义[3]:
药物与AAG具有很高的亲和力,如结合常数Ka > 105 M−1,意味着药物与AAG结合的趋势非常强,可能在血浆中主要以结合状态存在。
稳态分布容积(Volume of distribution at steady-state,Vdss)较小,表明药物在体内分布的范围有限,大部分药物可能存在于血液中。
AAG是血浆中药物的主要结合蛋白,说明药物在血浆中的分布和动力学特性可能受AAG的影响。在药物开发过程中,我们建议除测定血浆的总结合外,还需要测试药物与血浆白蛋白和糖蛋白的结合情况,这有助于前瞻性的预测人体药代动力学表现。为此,业内专家制定了相应的决策流程图[1] (图3)。
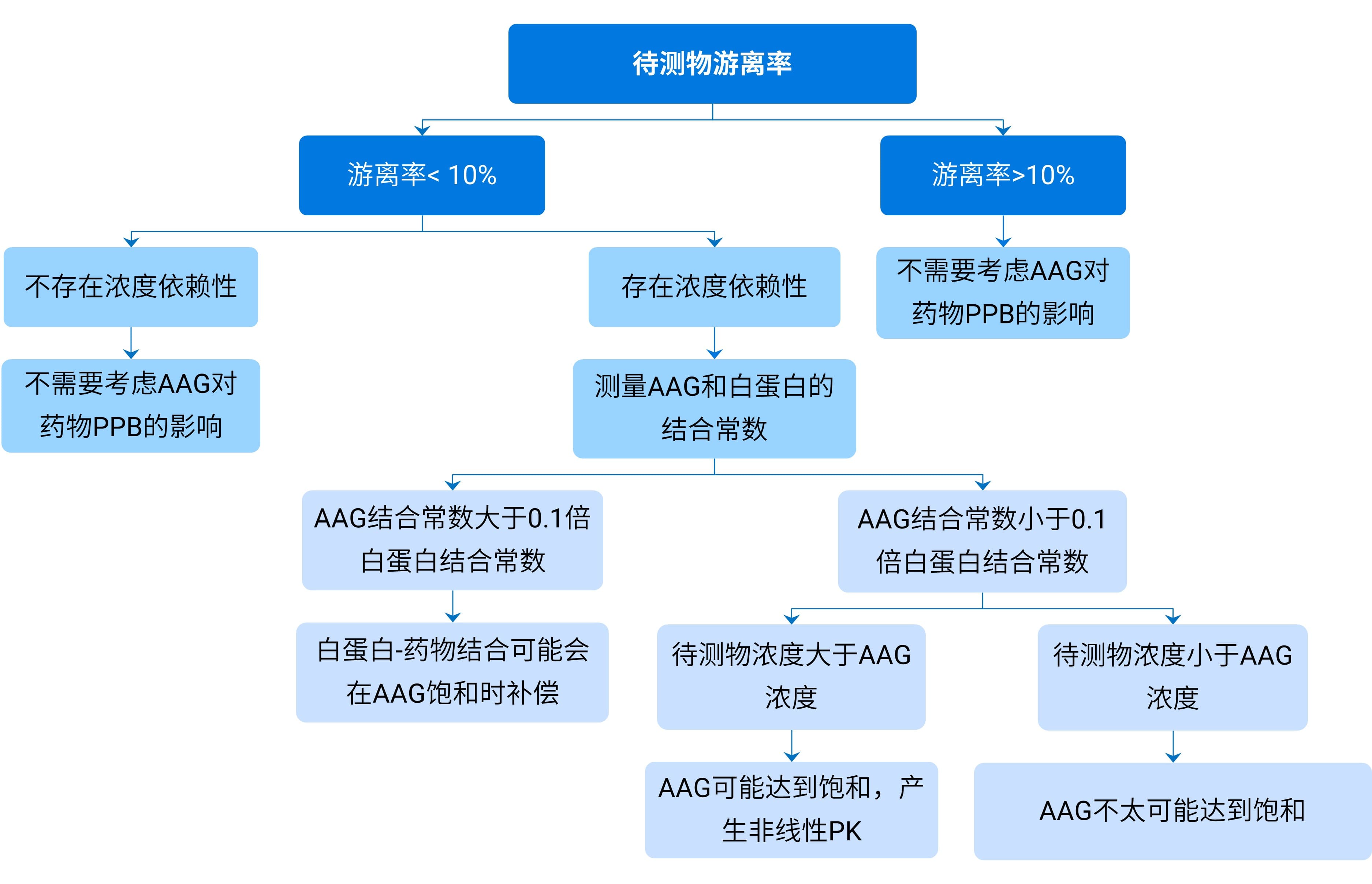
图3. 评估AAG是否构成导致药代动力学(PK)变异性的潜在协变量的流程图
在开展AAG蛋白结合实验时,需要特别注意以下事项:
考虑塑化剂的影响:实验中应注意基质收集和储存过程中塑化剂的潜在干扰。部分塑化剂可能会从储血袋中渗出并影响药物与蛋白的结合,如DEHP等。
蛋白结合的浓度依赖性:设计实验时要考虑药物与AAG蛋白质结合可能的浓度依赖性。
AAG水平的变化:在不同疾病状态下,AAG水平可能发生的变化会影响药物的结合特性。因此,实验设计应该考虑疾病状态下AAG水平的潜在变化。
跨种属比较:当药物在不同种属之间显示出显著的结合差异时,需要特别注意。
通过关注这些,研究人员可以更准确地设计蛋白结合实验和理解结果,从而为药物的开发和临床应用提供更可靠的数据。
结语
综上所述,AAG作为血浆中重要的药物结合蛋白,其独特性质(包括在疾病状态下的变化)对药物的药效和毒性具有重要影响。因此,在药物开发和临床应用中,我们需要将其纳入考量范围。此外,AAG还具有作为生物标志物的潜力,可以反映疾病状态和药物治疗的反应性。为了充分考虑AAG的这些功能,我们需要准确地测量和解析AAG与药物的结合。
作者:李梦瀛,王洁,王翔凌,陈根富
编辑:富罗娜·克里木,钱卉娟
设计:倪德伟,张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系
参考
[1] Smith SA, Waters NJ. Pharmacokinetic and Pharmacodynamic Considerations for Drugs Binding to Alpha-1-Acid Glycoprotein. Pharm Res. 2018 Dec 28;36(2):30
[2] Kelly Wang, Bernard Murray. The influence of alppha-1 acid glycoprotein binding on total plasma free fraction and the effect on clinical pharmacokinetics. Poster presented on the 26th North American ISSX/JSSX meeting, September 15-18, 2024.
[3] Bohnert T, Gan LS. Plasma protein binding: from discovery to development. J Pharm Sci. 2013 Sep;102(9):2953-94.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息