近年来,全球创新药研发如火如荼,生物医药产业已成为发展最活跃的产业之一。一个新药的成功研发上市需要经过复杂的过程,包括药物作用靶点的选择、先导化合物的筛选、临床候选化合物的确定、临床药效的确证以及药物的安全性评价等等。当靶点筛选获得了具有体外药效活性的分子结构,即希望其能在体内具有合适的暴露量和作用时间,而药物的快速代谢清除往往会减少药物的暴露。想要改善快速代谢的特性,最重要的是能够识别化合物分子的代谢位点,并对其加以保护。化合物容易发生体内或体外代谢反应的化学基团或单个原子,称之为“代谢软点(soft spot)”。
药物发现早期的代谢软点鉴定研究可以准确地识别化合物分子的代谢软点,从而帮助化学家有目的地进行先导化合物结构优化。代谢软点鉴定涉及化合物的分离和结构解析,是一项复杂耗时的工作,而早期的化合物选择阶段往往需要快速高通量的技术,以更快更好的为大规模化合物结构优化提供帮助。本文将介绍代谢软点在化合物结构优化中的作用和一种基于软件进行高通量代谢软点鉴定研究的方法,以助力先导化合物的确定,加速新药研发。
一、为什么开展代谢软点鉴定研究
药物主要通过代谢和排泄的方式从体内消除,其中代谢是大部分药物的主要消除方式。化合物通过I相代谢和II相代谢,将脂溶性的化合物转化为极性更强、水溶性更好的化合物,通过胆汁和尿液排出体外。细胞色素P450(CYP)酶是药物I相代谢的主要贡献者,几乎四分之三的上市药物在其消除过程中有CYP酶的参与[1],并且对其中许多药物来说,这一途径对其血药浓度和给药方案有重大影响,这些酶也与个体间的高变异性以及药物相互作用的风险有关。当候选化合物表现出高度CYP酶依赖性清除时,应当设法减弱相关酶的作用,增强化合物的代谢稳定性[2]。
目前,针对CYP酶代谢的稳定性,主要选择肝微粒体模型,通常采用高通量的肝微粒体孵育考察代谢稳定性,确定化合物的体外代谢半衰期。通过半衰期与体内清除速率预测化合物的临床前毒性和药效研究中的药代动力学特征。但是,肝微粒体清除试验并不能提供化合物在肝微粒体的代谢信息,只有结合代谢软点鉴定研究,才能在快代谢的基础上明确化合物的代谢“软点”,指导化合物进行结构优化,提高其代谢稳定性。
二、以代谢为基础进行药物设计的策略
随着结构表征和计算机模拟技术的不断发展,以代谢为基础辅助进行药物设计的策略也被广泛应用,现阶段已开发出了一系列通过改变主要代谢途径的先导化合物结构优化策略,主要包括:封闭代谢位点、骨架修饰、生物电子等排以及前药修饰等[3]。
封闭代谢位点
封闭代谢位点可以阻断代谢途径,提高化合物代谢稳定性,氟原子是最常用的封闭基团。在药物设计中,通常在小分子化合物中引入氟原子取代,对易氧化代谢的位点进行封闭,选择性地阻止氧化代谢的发生。如SCH58235的前体药物SCH48461含有多个氧化和去甲基化代谢位点,具有代谢消除速率快、生物利用度低等缺点,通过在先导化合物的苯环上引入氟原子,封闭氧化代谢位点,从而增强了药物的代谢稳定性同时也提高了活性[4]。
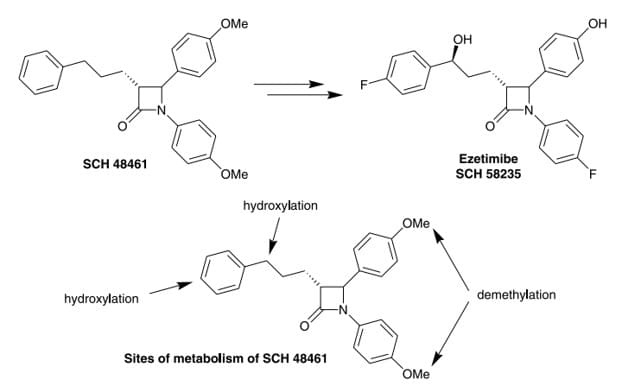
图1. SCH58235和SCH48461的结构[4]
除氟原子外,氯原子、氰基和氘也可以用于封闭代谢位点。氘代策略可以阅读:以临床价值为导向的氘代药物研发策略。
骨架修饰
骨架修饰也可以改变代谢途径,提高代谢稳定性。骨架修饰包括改变环的大小、成环修饰、连接链长短以及骨架跃迁等,通过骨架修饰可以改变化合物的母核,增加代谢位阻或者减少代谢软点。近年来,随着以VHL、CRBN为代表的小分子E3连接酶配体的发现,基于酶抑制剂设计PROTACs(即Proteolysis-Targeting Chimeras,在上下文中简称为“PROTAC”)降解剂,诱导酶降解的策略迅速成为研究热点[5]。Goracci等人[6]比较了PROTAC分子及其组成配体的代谢软点和代谢速率,发现如下表1所示的稳定性规律。可见,对PROTAC分子进行骨架修饰能帮助增强代谢稳定性,同时也可以减少潜在的脱靶毒性。
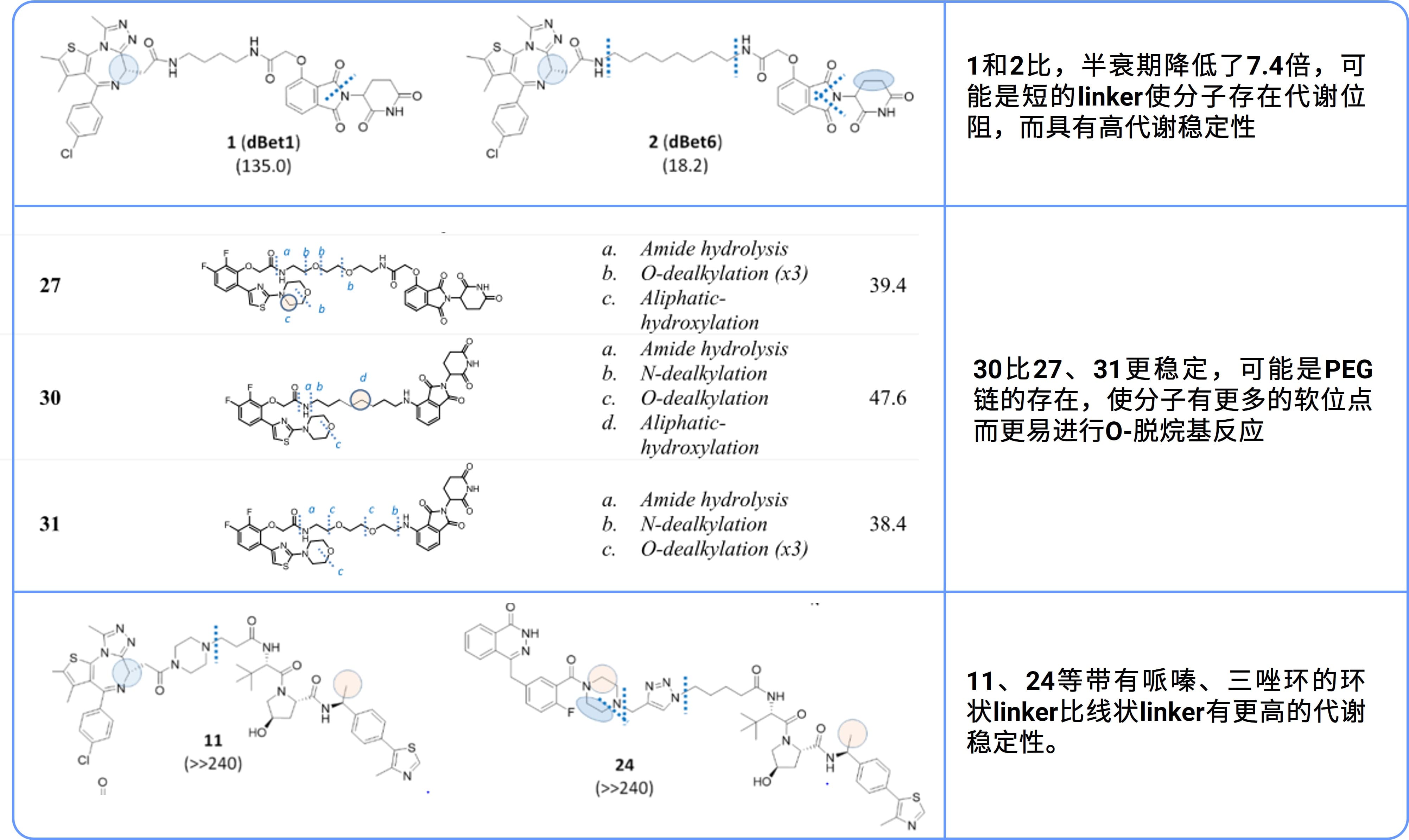
“开环”和“扣环”策略
将容易发生代谢的环状结构进行“开环”和“扣环”,得到了一类新型骨架,也可以阻断代谢,提高稳定性。趋化因子受体CXCR4在HIV感染、炎症/自身免疫性疾病和肿瘤转移中有重要作用,其被认为是药物靶点。Li Zhanhui等[7]合成了一系列基于氨基嘧啶骨架的CXCR4拮抗剂,它们具有不错的活性,但存在肝微粒体快速清除的问题,然后科学家通过广泛的结构-代谢关系研究发现,四氢喹啉(THQ)结构可能是清除率高的罪魁祸首。Robert J. Wilson[8]等研究也发现在小鼠肝微粒体中,THQ片段的羟基化导致了化合物的高清除率(图2)。基于此,科学家将容易发生羟基化的THQ片段进行“开环”,并和N-甲基进行“扣环”,得到了一类新型骨架的CXCR4拮抗剂(图3),其中化合物46在人和大鼠肝微粒体中的代谢稳定性大大提高。
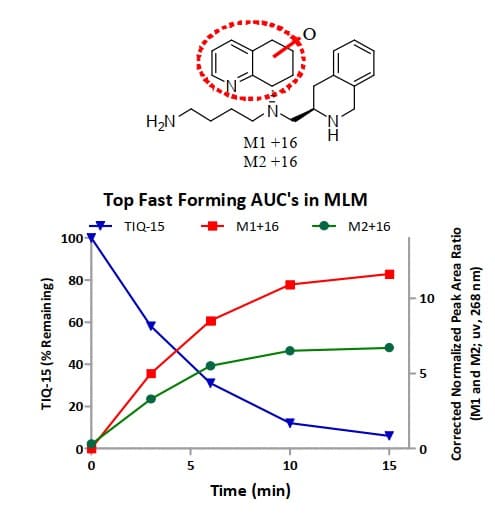
图2. TIQ-15在小鼠肝微粒体中的代谢结果
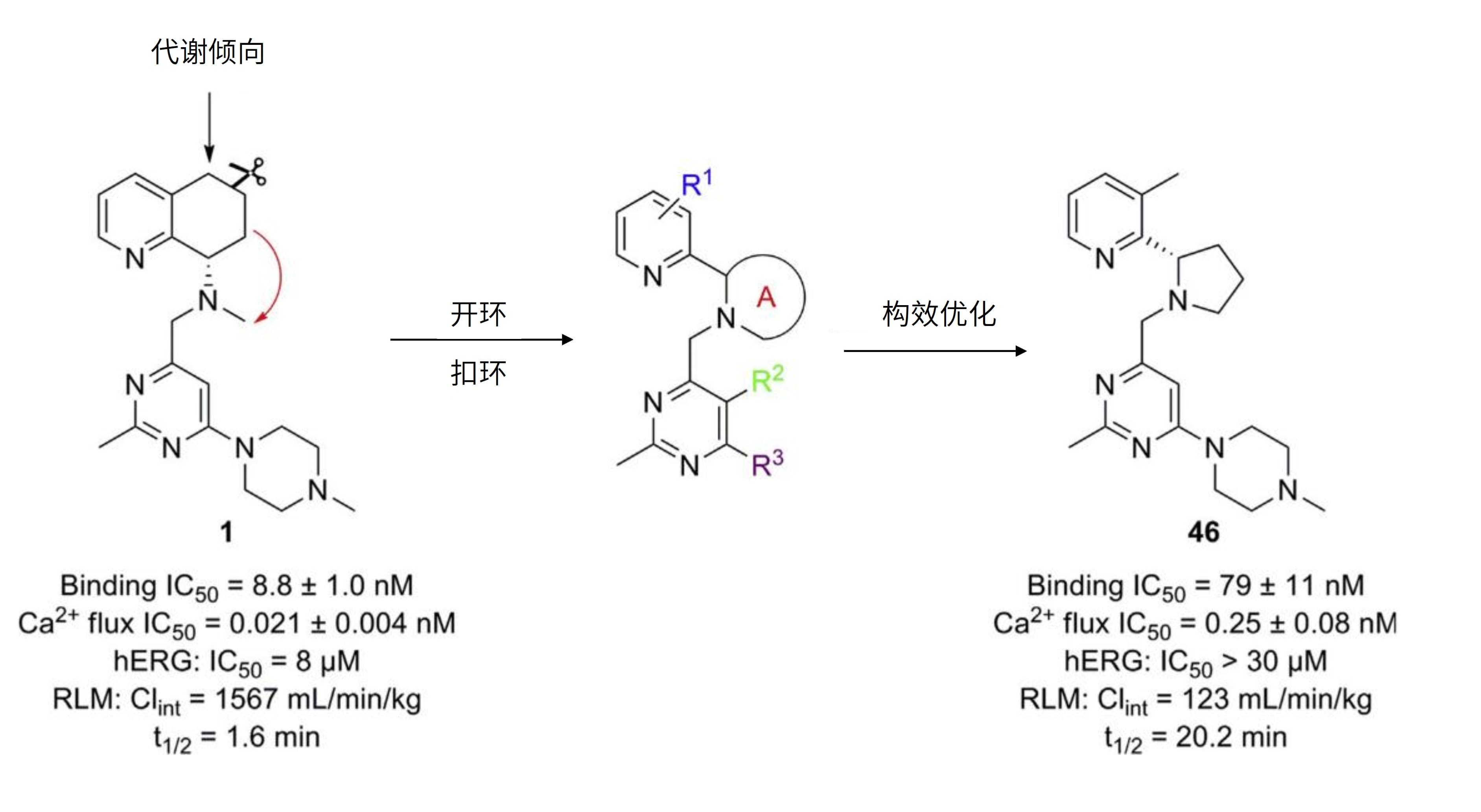
图3. “开环”和“扣环”设计
前药修饰
前药本身没有生物活性或活性很低,经过体内代谢后变为有活性的物质,前药修饰的主要目的在于提高药物的代谢稳定性,延长药物在体内的作用时间、增加药物的生物利用度,降低药物的毒性和副作用等。
以上描述了部分以代谢为基础辅助进行药物设计的策略,而结构改造的基础,首先是研究稳定性较差的药物发生了哪些代谢及存在哪些“软点”,将在下文为大家介绍。
三、如何高通量进行代谢软点鉴定研究
传统的代谢产物鉴定过程中,不仅需要长时间的LC-MS分析方法以确保各代谢产物之间以及和生物基质组分实现色谱分离,而且还需要大量的人工数据解析工作。因此实验周期较长,很难满足早期药物发现阶段的通量要求,所以快速高通量的代谢软点鉴定方法就显得尤为重要。
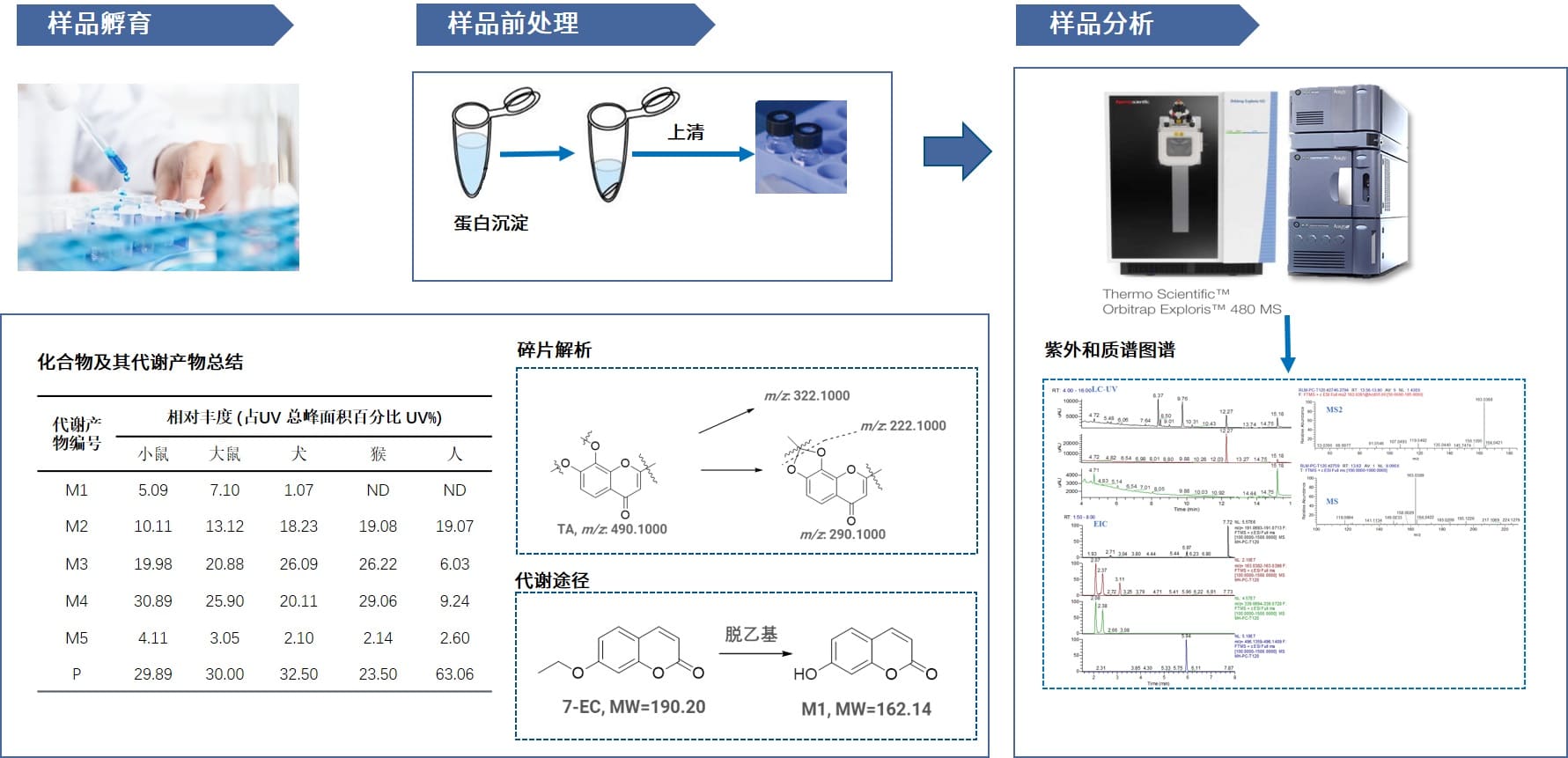
图4. 高通量代谢软点鉴定实验流程
样品孵育:样品孵育时间会直接影响化合物的代谢程度,快代谢化合物可能会因为过长的孵育时间导致无法判断代谢软点。所以需要根据化合物代谢稳定性结果,定制化设计孵育时间,减少因过度代谢而引入的次生代谢,更清晰地暴露初级的软点代谢。
样品检测:不同类型的化合物具有不同的理化性质,对高通量样品检测是一项挑战,目前,药明康德药性评价部代谢软点鉴定平台配置了多台超高效液相色谱和不同型号的高分辨质谱仪,适用于多种类型的化合物检测。此外,丰富的LC-MS方法开发经验,可以缩短样品的检测时间。利用UPLC高分离度、高速度、高灵敏度等优势,确保在5-15分钟实现化合物及其代谢产物的保留与分离。高分辨质谱(HRMS)进行样品检测,利用HRMS高分辨率、高质量精度、宽动态范围等优势,确保获得更精准的质荷比信息;同时多种数据采集模式(Full MS/dd-MS2/MSE)和丰富的离子过滤功能(质量亏损、背景扣除、中性丢失、特征子离子等)用于寻找代谢产物,并提供准确的碎片信息用于归属代谢软点。
数据解析:大量的数据解析工作一直是限制代谢软点鉴定工作效率的难点之一,为了加快这一步骤的进程,我们引进了诸多数据处理软件(Compound Discovery、MetaboLynx、MS Frontier、MetWorks 和 Mass-MetaSite)。经过软件各参数的调整与优化,可对谱图进行自动化解析,再结合资深科学家的丰富经验对解析结果进行合理的判断及使用,以促进高效率的高质量的代谢物结构解析。
此外,结合代谢稳定性实验进行代谢软点检测,可以跳过重复孵育的过程,直接对代谢稳定性实验的样品进行检测,并结合多个时间点的结果进行比较分析,得到不同时间点的代谢优势位点。
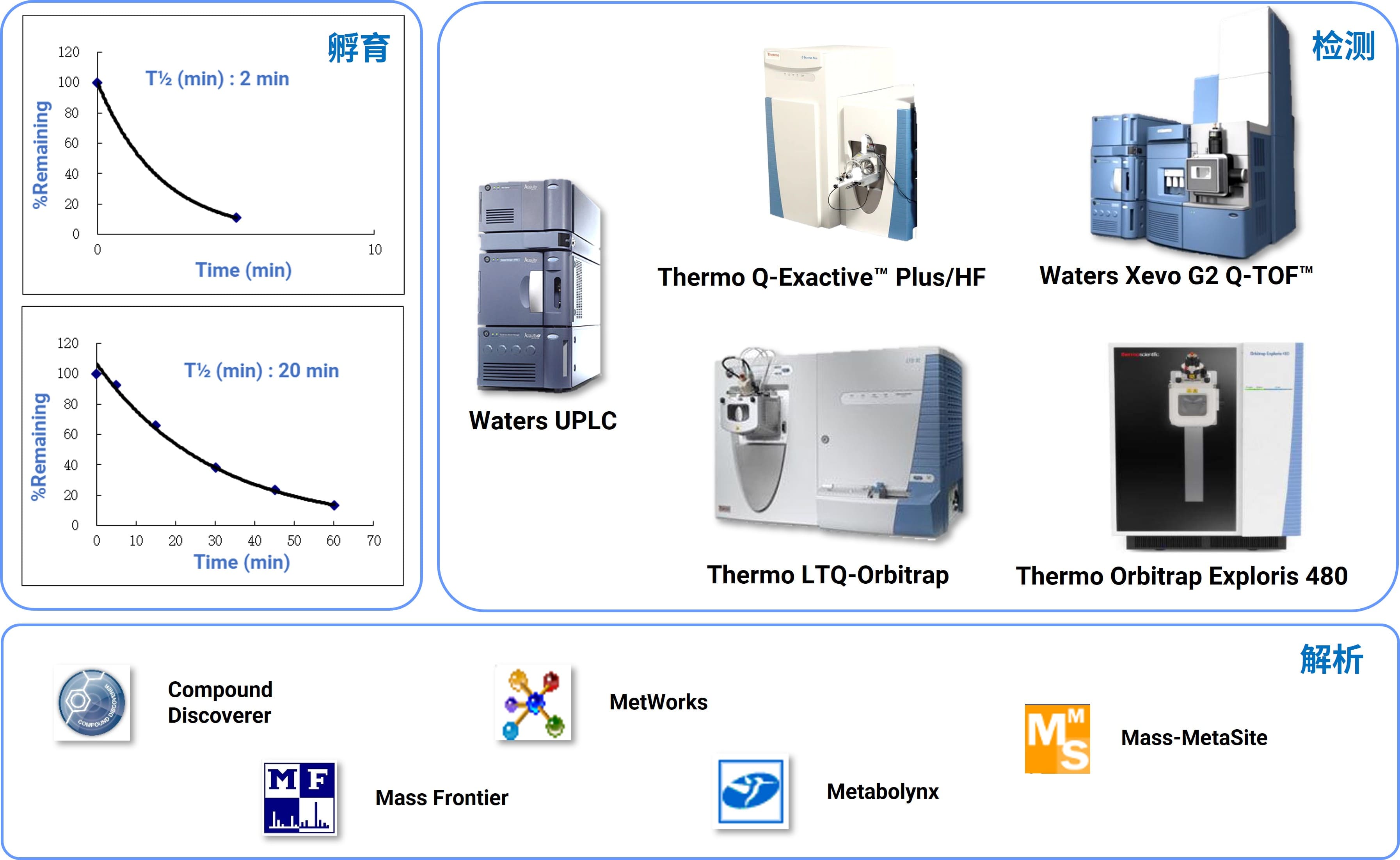
图5. 代谢软点鉴定平台
总结与展望
代谢软点鉴定实验不仅能获得化合物在肝微粒体或肝细胞中代谢成了什么,同时也能明确代谢“软点”,帮助化学家对其进行结构优化,通过阻断药物代谢软点,提高化合物的代谢稳定性。
传统的代谢产物鉴定研究耗时较长,不能完全满足前期先导化合物优化对时效和通量的需求。近年来,随着仪器采集和数据处理软件等技术的不断发展,以及化学信息学、化学计量学、统计学、计算机科学等与药学的多学科交叉,在一定程度上实现了代谢产物鉴定的自动化过程。虽然,自动化鉴定结果存在一定的假阳性,但是通过软件结合资深科学家的解析判定很大程度上加速了代谢软点的研究进程,也能更好的为化合物结构优化提供参考。
面对药物研发初期的快速筛选需求,药明康德DMPK的代谢软点鉴定平台基于超高效液相-高分辨质谱(UPLC- UV-HRMS)技术、专业的数据处理软件和丰富的研究经验,在确保质量的前提下不断提高速度和通量,已为全球众多客户提供了不同类型的代谢软点鉴定研究服务,助力客户精准优化代谢软点,加速研发进程。
作者:唐明,蔡婷婷,张玲玲,曹卫群
编辑:方健,钱卉娟
设计:倪德伟
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系
参考
[1] Kennedy, T. Managing the drug discovery/development interface. Drug DiscoVery Today 1997, 2, 436–444.
[2] Trunzer M, Faller B, Zimmerlin A. Metabolic soft spot identification and compound optimization in early discovery phases using MetaSite and LC-MS/MS validation [J]. Journal of Medicinal Chemistry, 2009, 52(2):329.
[3] 王江, 柳红. 先导化合物结构优化策略(一)——改变代谢途径提高代谢稳定性[J]. 药学学报, 2013, 48(10):11.
[4] Purser S, Moore P R, Swallow S, et al. Fluorine in medicinal chemistry[J]. Chem.soc.rev, 2008, 37(2):320-330.
[5] Gao, H.; Sun, X.; Rao, Y., PROTAC Technology: Opportunities and Challenges. ACS Medicinal Chem. Lett. 2020, 11 (3), 237-240.
[6] Goracci L, Desantis J, Valeri A, et al. Understanding the Metabolism of Proteolysis Targeting Chimeras (PROTACs): The Next Step toward Pharmaceutical Applications [J]. Journal of Medicinal Chemistry, 2020, 63(20):11615–11638.
[7] Li Zhanhui, Wang Xu, Lin Yu, et al. Design, synthesis, and evaluation of pyrrolidine based CXCR4 antagonists with in vivo anti-tumor metastatic activity.[J] .Eur J Med Chem, 2020, 205: 112537.
[8] R.J. Wilson, E. Jecs, E.J. Miller, et al. Synthesis and SAR of 1,2,3,4-tetrahydroisoquinolinebased CXCR4 antagonists, ACS Med. Chem. Lett. 9 (2018) 17e22
[9] Antonia F. Stepan, Vincent Mascitti, Kevin Beaumontc and Amit S. Kalgutkar. Metabolism-guided drug design, Med. Chem. Commun., 2013,4, 631-652.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息












