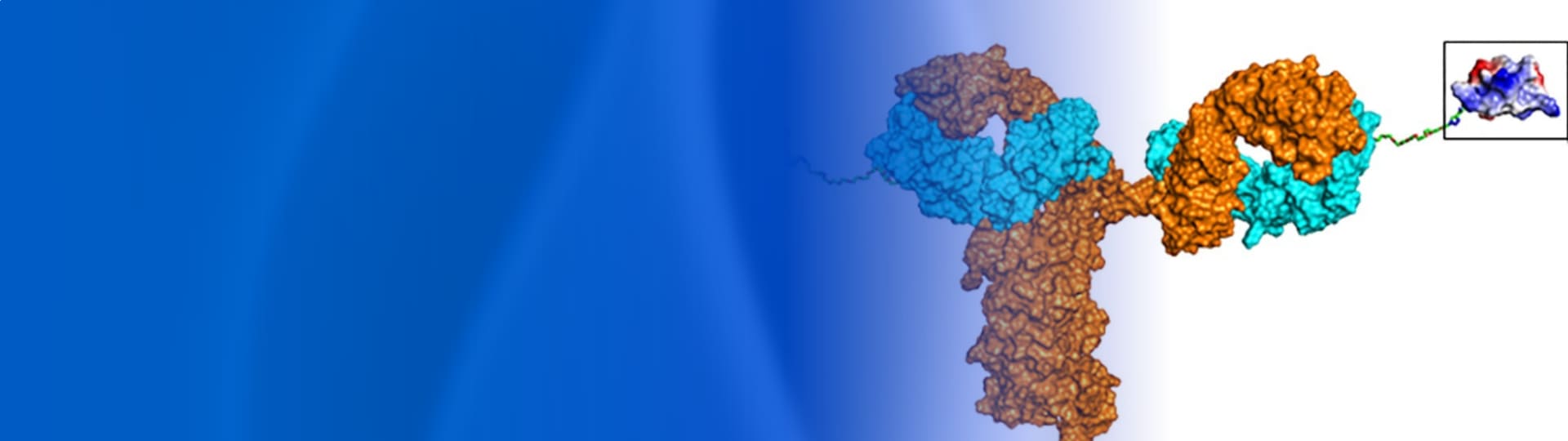
偶联药物,因其临床结果和潜在商业价值吸引了行业的广泛关注,已成为医药研发的热门领域。其中,发展最为成熟的一类是抗体偶联药物(ADC)。自2000年FDA批准Mylotarg®用于成人急性髓系白血病到2024年11月芦康沙妥珠单抗获中国国家药监局批准,全球已有16款ADC药物获批上市,覆盖实体瘤和血液瘤的多个靶点。与此同时,其他类型的偶联药物也在蓬勃发展,例如多肽偶联药物(PDC)、抗体-多肽偶联物(APC)、寡核苷酸偶联抗体(AOC)、抗体偶联降解剂(DAC)、核素偶联药物(RDC)和小分子药物偶联物(SMDC)等。随着偶联技术的飞速发展和迭代,全球已然进入百花齐放的偶联药物时代。
本文主要介绍APC(antibody-peptide conjugate),APC通常由抗体(antibody)、多肽(peptide)和连接子(linker)组成。2024年2月,安进在Nature Metabolism上发表了在研APC药物AMG 133(GIPR单抗-GLP-1类似物偶联物)针对肥胖适应症的Ⅰ期临床研究结果[1],显示肥胖患者每月仅需要一针,接受高剂量AMG 133治疗85天后,体重可降低14.5%(约26斤)。更为瞩目的是,这些患者在停药后150天,仍可维持体重降低11.2%。这些结果展现出AMG 133在肥胖治疗领域的惊人潜力,也表明APC药物领域正在取得突破性进展。本文对APC药物及其药代动力学研究进行了介绍,以期加深对APC药物的认识并为APC药代动力学研究提供参考。
APC药物介绍
根据APC的组成,可分为:
以多肽为药效组分的APC;
以抗体为药效组分的APC;
抗体和多肽均为药效组分的APC。
对于第一类APC(如图 1A),抗体部分主要发挥靶向、提高多肽药物稳定性和延长半衰期、增加多肽在靶点的积累并降低系统毒性等作用。第二类APC(如图 1B)由归巢肽或其他功能肽、连接子和治疗性抗体组成,主要用于改善抗体组织渗透性差和分布不均的性质,提高抗体给药的治疗效果和安全性。第三类APC(如图 1C)的机制与双/多特异性抗体类似,即抗体和多肽均为特异性分子,可作用于同一疾病的不同靶点发挥阻断或激动效果,达到协同治疗的作用。目前,已报道的部分APC药物信息汇总见表 1。
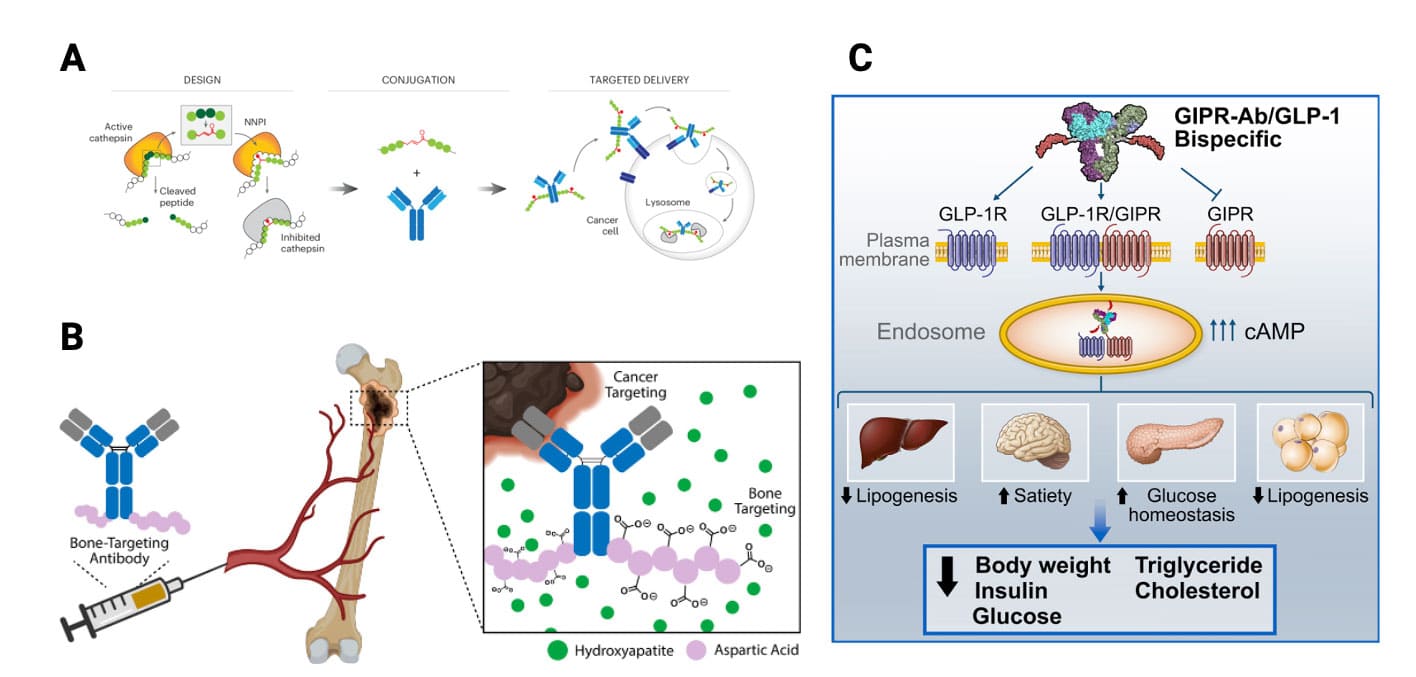
图1. 不同种类APC药物.(A)肿瘤靶向抗体-组织蛋白酶肽抑制剂偶联物[2];(B)骨归巢肽-曲妥珠单抗偶联物[3];(C)GIPR-Ab/GLP-1类似物偶联物[4]
表1. 已报道的部分APC药物信息汇总
APC名称 | 研发公司 | 开发阶段 | 抗体 | 多肽 | 药效组分 | 治疗领域 | 给药途径 | 参考文献 |
AMG 133 | Amgen | 临床2期 | GIPR-Ab | GLP-1类似物 | 多肽×抗体 | 肥胖 | IV, SC | [1] |
AMG 570 | Amgen | 临床2期 | ICOSL-Ab | BAFF抑制肽 | 多肽×抗体 | 系统性红斑狼疮、类风湿性关节炎 | IV, SC | [5,6] |
CX-072 | CytomX | 临床2期 | PD-L1-Ab | 掩蔽肽 | 抗体 | 肿瘤 | IV | [7,8] |
抗体-JzTx-V肽偶联物 | Amgen | 临床前 | αDNP-Ab | JzTx-V系列肽 | 多肽 | 疼痛 | IV, SC | [9] |
CI107 | CytomX | 临床前 | Ab (EGFR×CD3) | 掩蔽肽 | 抗体 | 肿瘤 | IV | [10] |
EGFR单抗前体药物 | CytomX | 临床前 | EGFR-Ab (西妥昔单抗) | 掩蔽肽 | 抗体 | 肿瘤 | IV, IP | [11] |
抗体-胃泌酸调节素类似物偶联物 | Janssen | 临床前 | 免疫沉默IgG4 | 胃泌酸调节素类似物 | 多肽 | 肥胖 | SC | [12] |
注:Ab:抗体;GIPR:葡萄糖依赖性促胰岛素释放多肽受体;
GLP-1:胰高血糖素样肽-1;ICOSL:诱导T细胞共刺激配体;PD-L1:细胞程序性死亡-配体1;DNP:2,4-二硝基苯酚;EGFR:表皮生长因子受体;CD3:分化簇3;IV:静脉注射;SC:皮下注射;IP:腹腔注射。
APC药物的药代动力学性质
APC药物的药代过程受到结构中三个组分的影响。其中抗体为主体部分,本身具有清除率低、半衰期长、表观分布容积低等药代特征。但是APC药物的整体药代动力学特征还受连接子、多肽和偶联比(DAR)的影响。
吸收
APC药物由于分子量大难以透过胃肠道屏障,同时在胃肠道环境中容易水解和蛋白变性,无法口服给药。如上表所示,目前开发的APC药物给药方式,以静脉和皮下注射为主。其中静脉注射不涉及吸收过程。而皮下注射的抗体药物一般先经淋巴系统吸收后被输送至血液循环中。
分布
APC药物的体内分布主要受靶标受体的分布及组织器官血流量的影响。APC药物进入血液循环后,需要穿过血管壁到达靶组织发挥作用。类似于抗体类的大分子,APC药物可能通过血液-组织液对流作用或者内吞作用先通过血管内皮细胞进入间质,然后再由细胞外基质进入靶标部位。大部分的APC药物含有靶向功能组分,如抗体或归巢肽。APC药物可以直接结合细胞表面抗原或受体,也可以在到达靶标组织后在特定pH环境或水解酶作用下在细胞外发生解离。总体而言,APC药物的分子量较大且亲脂性差,表观分布容积一般较低。
代谢
APC在体内主要有以下三种代谢途径。
靶点介导的特异性代谢途径
靶点介导的特异性代谢途径是指由APC的抗体部分的Fab段或多肽特异性氨基酸序列与靶细胞表面抗原或受体结合后内化进入细胞,并在溶酶体中被降解为多肽片段或氨基酸的过程。由于细胞表面的抗原/受体的位点数量有限,因此这种途径具有可饱和性并使APC的PK表现出非线性特征,即清除率随剂量增高而降低,而半衰期随剂量增高而延长。在剂量足够高时,这种消除途径成为非主要途径而使非线性PK转变为线形PK。此外,少量位于细胞表面的抗原可能会脱落而成为可溶性抗原,APC抗体部分也可与这些抗原结合形成免疫复合物并最终被消除。
非特异性代谢途径
APC可以通过非特异性胞饮,或经巨噬细胞、自然杀伤细胞等表面Fcγ受体介导的内吞作用进入细胞内。其中一部分APC分子被内化后在溶酶体的作用下,被降解成多肽片段或氨基酸;另一部分APC则在弱酸性条件下,通过Fc区与新生儿Fc受体(FcRn)结合被转运至细胞表面而免于被降解,从而降低体内清除率,延长生物半衰期。非特异性代谢途径有可能导致搭载的多肽药物释放至非预期靶点,导致脱靶的副作用。其他非特异性代谢途径还包括掩蔽肽和一些连接子在特定的pH环境和一些水解酶作用下断裂的过程(如肿瘤组织的微酸环境和基质金属蛋白酶等)。
APC药物的免疫原性
与其他大分子类药物相似,APC可能会导致免疫原性,刺激机体产生抗药抗体(ADA)。ADA可与药物特异性结合形成复合物,进而被免疫系统消除,这种中和作用成为APC的另一种清除机制。
排泄
完整的APC药物由于其分子量较大,不能直接被肾小球滤过清除。APC代谢后产生的多肽药物、多肽片段和氨基酸可能低于肾小球的过滤阈值(60 kDa),而通过肾脏排出。此外,这些低分子量代谢产物也可能通过转运体的介导通过胆汁排泄。
APC药物的药代动力学研究案例分享
AMG 133 (Maridebart cafraglutide)
AMG 133是安进公司开发的GIPR/GLP-1R双特异性分子(图2)。临床前和临床研究显示AMG 133具有可接受的安全性和耐受性,并具有明显的剂量依赖性体重减轻效果。在临床多次递增剂量组中,体重减轻在最后一次给药后可维持150天[1]。
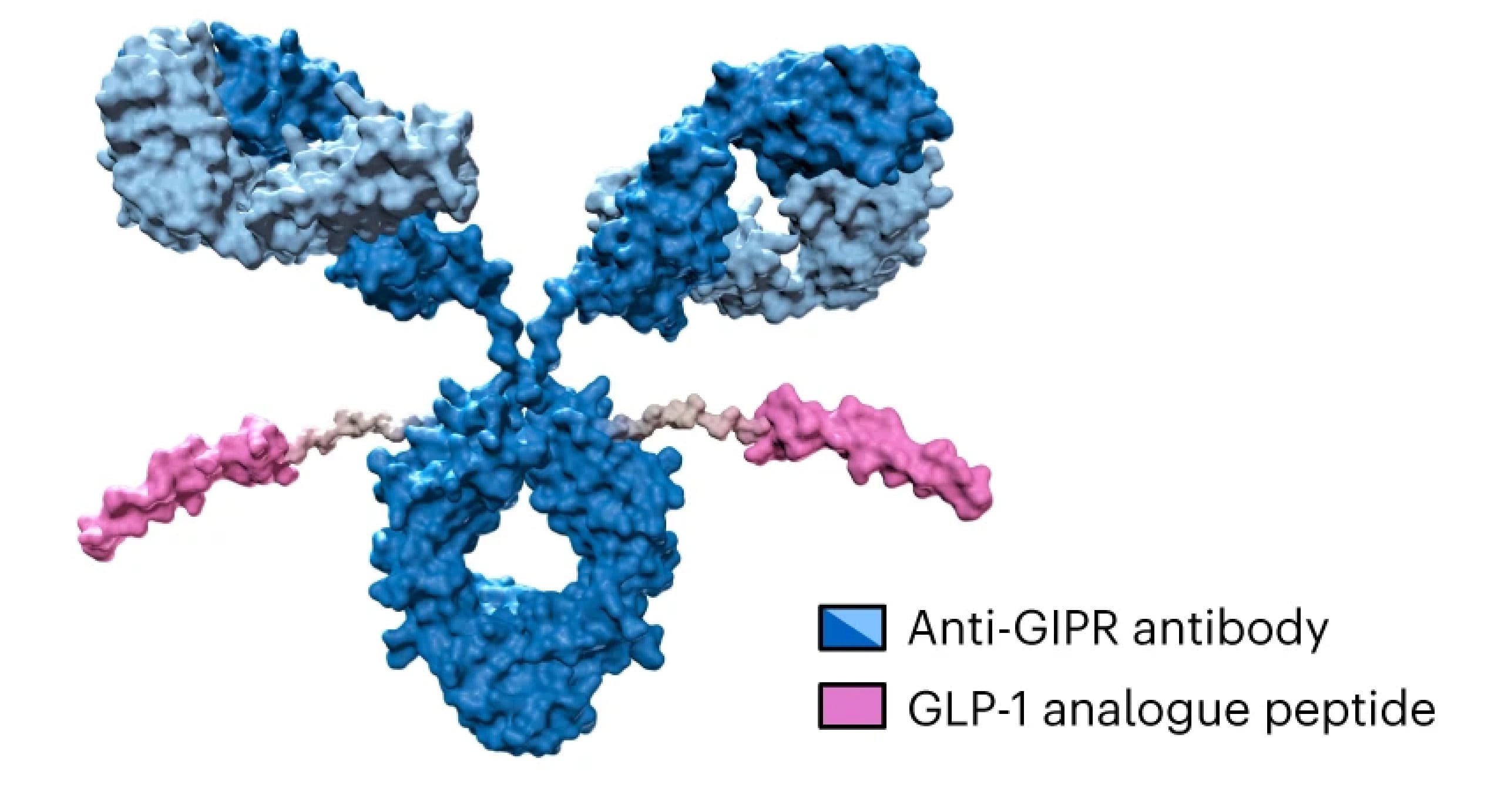
图2. AMG 133的结构[1]
AMG 133临床前药代动力学研究
AMG 133的临床前PK研究在CD-1小鼠、正常和肥胖食蟹猴中进行,血浆中的完整AMG 133(带有至少一个GLP-1类似肽的GIPR-Ab)和总抗(带有或不带有GLP-1类似肽的GIPR-Ab)浓度通过ELISA方法进行检测,二者的分析方法检测范围均为30~2000 ng/mL。
小鼠单次静脉注射5 mg/kg后,完整AMG 133和总抗的C0相近(127 vs 109 μg/mL),但完整AMG 133的清除率(CL)更快(0.568 vs 0.367 mL/h/kg),终末半衰期(t1/2)更短(118 vs 206 h),暴露量(AUC0-inf)更低(8840 vs 13700 μg·h/mL),见表2。
食蟹猴单次皮下注射3 mg/kg AMG 133后的PK参数如表3所示。与CD-1小鼠的PK数据类似,完整AMG 133与总抗相比,t1/2更短(207 vs 292 h), 暴露量(AUC0-inf)更低(9110 vs 15300 μg·h/mL)。
肥胖雄性食蟹猴多次(每周一次,持续6周)皮下注射给予AMG 133后的PK参数如表4所示。在0.5 mg/kg至1 mg/kg的剂量范围内,AMG 133均表现出较长的半衰期,完整AMG 133和总抗分别为189~222 h和231~284 h。完整AMG 133和总抗的血浆暴露量随着剂量增长而增加。与非肥胖食蟹猴PK数据相比,在肥胖食蟹猴中的经剂量校正的血浆暴露量更低。
表2. CD-1小鼠单次IV给药5 mg/kg的AMG 133后的PK参数[1]
AMG 133 | C0 (μg/mL) | t1/2 (h) | AUC0-inf (μg·h/mL) | Vss (mL/kg) | CL (mL/h/kg) |
Total | 109 | 206 | 13700 | 103 | 0.367 |
Intact | 127 | 118 | 8840 | 83.4 | 0.568 |
表3. 雌性食蟹猴单次SC给药3 mg/kg的AMG 133后的PK参数[1]
AMG 133 | Cmax (μg/mL) | t1/2 (h) | tmax (h) | AUC0-last (μg∙h/mL) | AUC0-inf (μg∙h/mL) | CL/F (mL/h/kg) |
Total | 30.4 | 292 | 48 | 13200 | 15300 | 0.198 |
Intact | 24.8 | 207 | 96 | 8550 | 9110 | 0.334 |
表4. 雄性肥胖食蟹猴连续SC给与AMG 133后的PK参数[1]
AMG 133 | Dose (mg/kg) | Cmax (μg/mL) | t1/2 (h) | tmax (h) | AUC0-last (μg∙h/mL) | AUC0-inf (μg∙h/mL) | CL/F (mL/h/kg) |
Total | 1 | 4.79 | 231 | 96 | 1880 | 2270 | 0.456 |
0.5 | 3.59 | 284 | 168 | 1450 | 1900 | 0.277 | |
0.75 | 4.18 | 258 | 168 | 1620 | 2020 | 0.380 | |
Intact | 1 | 4.34 | 189 | 96 | 1400 | 1580 | 0.673 |
0.5 | 2.87 | 222 | 96 | 977 | 1160 | 0.461 | |
0.75 | 3.13 | 191 | 96 | 1030 | 1160 | 0.656 |
AMG 133临床药代动力学研究
受试者按3:1比例随机分配接受AMG 133或安慰剂治疗。单次给药剂量递增试验(SAD)在6个队列中对AMG 133在21~840 mg剂量范围内进行了评估。多次给药剂量递增试验(MAD)在3个队列中评估的剂量范围为140~420 mg,每隔4周在第1、29和57天给药。AMG 133或安慰剂采取皮下注射给药。临床阶段使用LC-MS/MS方法对完整AMG 133和总抗进行检测,定量下限为50 ng/mL。
在SAD队列所有剂量中,AMG 133在给药后约4~7天(中位tmax)达到最大浓度。完整AMG 133和总抗的平均t1/2分别约为14~16天和21~24天。在MAD队列中,中位tmax范围为给药后4~6天,与SAD队列一致。第57天最后一次给药后,完整AMG 133和总抗的暴露量(AUC0-28)如表6所示。
由于GIPR拮抗剂和GLP-1R激动剂的协同效应,AMG 133比单靶点的药物在临床前和临床实验中表现出更优的减肥效果。且由于多肽和抗体的结合,大大延长了GLP-1药物的半衰期,支持一个月一次的给药频率,比目前的GLP-1长效制剂Wegovy和Zepbound(一周一次)更能提高患者的依从性和便捷性。
表5. AMG 133临床实验SAD队列的PK参数[1]
| tmax (days) | t1/2 (days) | |||
剂量 (mg) | N | Intact AMG 133 | Total AMG 133 | Intact AMG 133 | Total AMG 133 |
21 | 6 | 5 | 5.9 | 14.3 | 21 |
840 | 6 | 5.4 | 5.5 | 16.5 | 23.8 |
表6. AMG 133临床实验MAD队列的PK参数[1]
剂量 (mg) | N | Intact AMG 133 AUC0-28 (day∙μg/mL) | Total AMG 133 AUC0-28 (day∙μg/mL) |
140 | 6 | 214 | 297 |
280 | 5 | 443 | 599 |
420 | 3 | 1220 | 1610 |
AMG 570 (Rozibafusp alfa)
AMG 570是安进公司开发的另一款APC药物,由诱导性T细胞共刺激配体(ICOSL)拮抗剂抗体AMG 557和B细胞活化因子(BAFF)抑制肽偶联而成,能够同时抑制①刺激T细胞的ICOSL信号通路和②刺激B细胞的BAFF信号通路,在治疗系统性红斑狼疮和类风湿性关节炎等自身免疫性疾病方面有广阔前景,目前已开发至临床II期阶段。
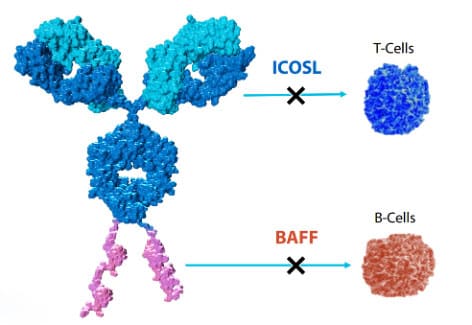
图3. AMG 570的结构[13]
AMG 570临床前药代动力学研究
在食蟹猴体内进行AMG 570的PK研究[6],雄性食蟹猴(n=4)单次静脉注射10 mg/kg的剂量,使用抗人IgG捕获和检测血清中的总抗,通过ICOSL-Fc捕获和生物素化BAFF来检测完整AMG 570的浓度。结果显示,血清中完整的AMG 570水平和变化趋势与总抗相似,见图4。此外也比较了AMG 570和ICOSL抗体AMG 577在食蟹猴体内的PK特性,发现AMG 570与ICOSL抗体AMG 577的PK参数比较接近,见表7。
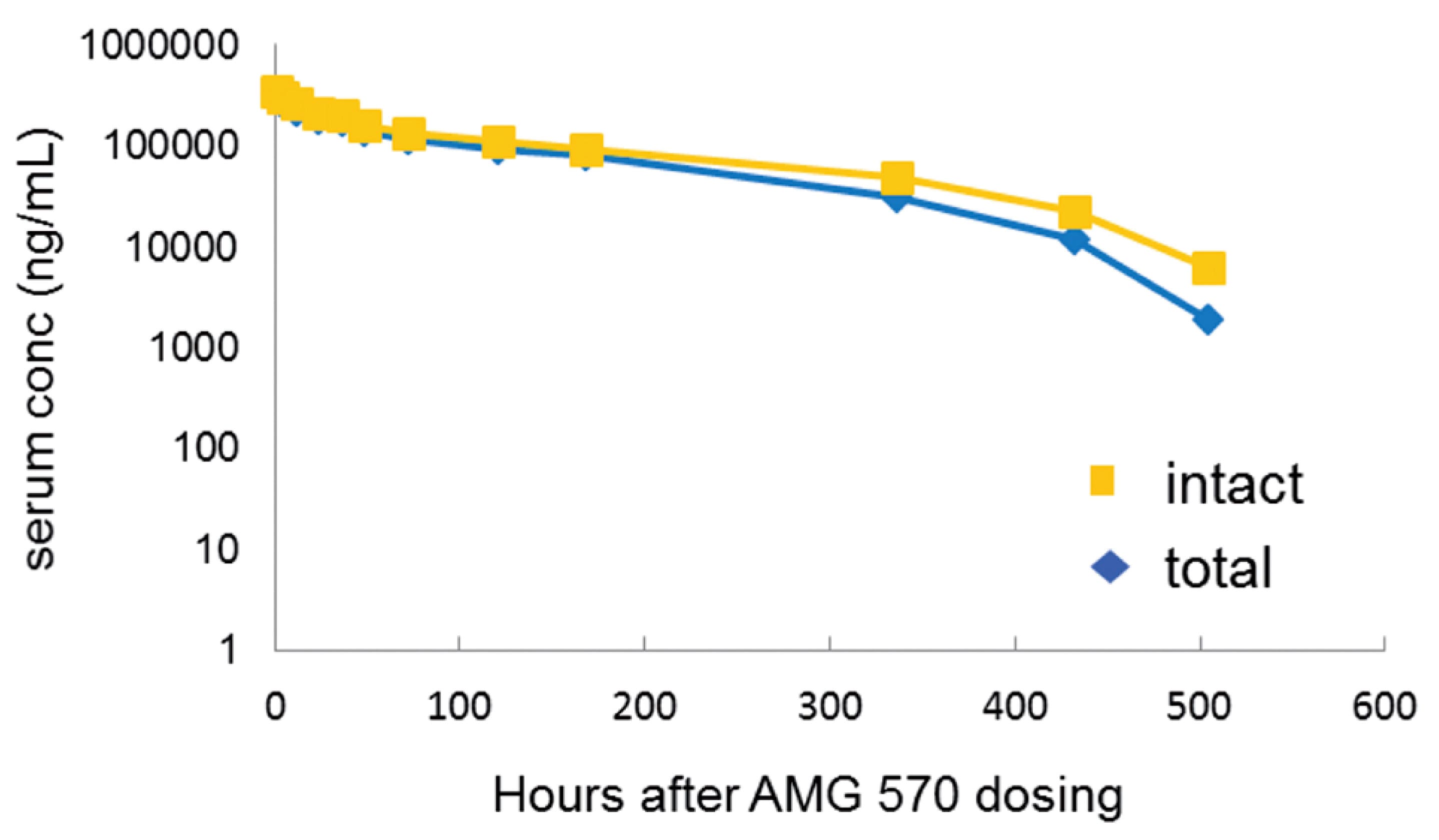
图4. 食蟹猴(n=4)单次静脉注射10 mg/kg AMG 570的PK曲线[6]
表7. AMG 570和AMG 557在食蟹猴体内的PK参数对比[6]
参数 | AMG 570 | AMG 557 | ||
给药方案 | 10mpk IV | 10mpk SC | 10mpk IV | 10mpk SC |
Cmax (μg/mL) | 323 | 90 | 264 | 112 |
Tmax (h) | -- | 45 | -- | 72 |
AUC0-inf (μg∙h/mL) | 33800 | 20300 | 26100 | 23800 |
MRT0-inf (h) | 136 | 132 | 138 | 144 |
CL (mL/h/kg) | 0.303 | 0.491 | 0.388 | 0.427 |
Vss (mL/kg) | 42.5 | -- | 52.1 | -- |
AMG 570临床药代动力学研究
受试者按3:1比例随机分配接受AMG 570或安慰剂治疗[7]。SAD在7个队列中对AMG 570在7~700 mg剂量范围内进行了评估。MAD在4个队列中评估的剂量范围为70~420 mg,每2周接受一次给药,共6次。AMG 570或安慰剂采取皮下注射给药。使用ELISA方法对AMG 570进行检测,定量范围为10-5000 ng/mL。
在SAD研究中,PK呈现非线性。中位tmax为给药后3至5天,平均t1/2为3.21天(7 mg)至7.00天(700 mg),高剂量下的t1/2有延长的趋势,清除率(CL/F)也随着剂量升高而降低。在7-700 mg的剂量范围内,Cmax和AUC0-inf均高于剂量比例增加,见表8。在MAD研究中,6次q2w给药后,Cmax和AUCtau的平均累积比分别为3.00-4.06和2.94-4.41,药物多次给药后存在蓄积。
表8. 健康受试者单次皮下注射AMG 570后的药代动力学参数[7]
Dose (mg) | Tmax (day) | Cmax (μg/mL) | AUC0-inf (μg∙day/mL) | t1/2 (day) | CL/F (L/day) |
7 | 5.0 | 0.0864 | 0.928 | 3.21 | 7.88 |
21 | 3.0 | 0.624 | 6.24 | 3.57 | 3.78 |
70 | 3.0 | 4.33 | 51.1 | 3.42 | 1.66 |
140 | 5.0 | 6.05 | 88.6 | 3.79 | 2.37 |
210 | 5.0 | 17.2 | 284 | 4.32 | 0.768 |
420 | 5.0 | 33.5 | 624 | 4.09 | 0.719 |
700 | 5.0 | 58.5 | 1660 | 7.00 | 0.504 |
抗体- NaV1.7抑制肽偶联物
Murray团队[9]从狼蛛毒液中发现了GpTx-1和JzTx-V多肽,这些多肽具有抑制电压门控钠通道NaV1.7的作用,有望成为新型止痛药物。其中GpTx-1与抗体偶联后(偶联物1)半衰期延长了130倍(80小时),但体内外的活性并不理想。JzTx-V肽是该团队进一步研究得到的具有更高活性的多肽,该团队制备了一系列的抗体-JzTx-V肽偶联物,并研究了不同偶联物的PK和PD性质。下文对这一探索性研究进行了分享。
探索一:不同连接子长度、对称方式和偶联比的偶联物
首先以αDNP抗体(非NaV1.7靶向,目前缺乏NaV1.7的有效抗体)的E384C为偶联位点,分别制备了偶联物2、3、4。其中偶联物2为对称偶联,连接子为PEG11,DAR=2;偶联物3为非对称偶联,同时使用加长的PEG连接子,DAR=2;偶联物4在3的基础上增加偶联比至4。增加连接子长度或不对称的几何形状可能会促进弹头与细胞膜相互作用。与2(IC50=75 nM)相比,3(IC50=7.8 nM)和4(IC50=2.3 nM)的体外活性均显著提高。
小鼠5 mg/kg给药后的PK研究中,偶联物2-4的总抗体暴露量水平和半衰期均远低于αDNP抗体或αDNP抗体-连接子对照组。在0.5 h后的血清浓度均已经低于未偶联的对照组,并在前24小时迅速下降。偶联物3和4与2相比,虽然通过增长连接子和/或提高偶联比提高了偶联物的体外活性,却相应地降低了血清暴露量。所有偶联物仅在8小时内达到1倍的暴露量倍数(血清浓度/hNaV1.7 IC50),远低于体内起效所需的浓度倍数。
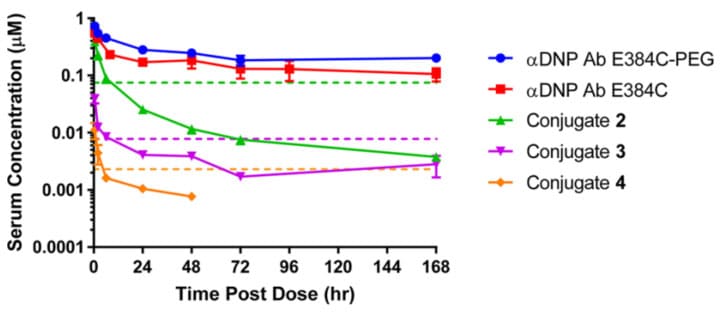
图5. CD-1小鼠静脉给予5 mg/kg不同偶联物和裸抗后总抗的血清药物浓度时间曲线[9]
为了进一步研究偶联物血清暴露量降低的原因,该团队使用未偶联抗体、偶联物1和4进行64Cu螯合剂衍生化,并通过PET/CT成像研究了小鼠给药后20小时的生物分布。结果显示未偶联抗体大部分仍在循环系统中,而偶联物4则大量沉积在肝脏中,其肝脏积累量是未偶联抗体和偶联物1的4倍。因此,增加JzTx-V肽偶联比可能促进了与肝脏组织的特异性结合和分布。
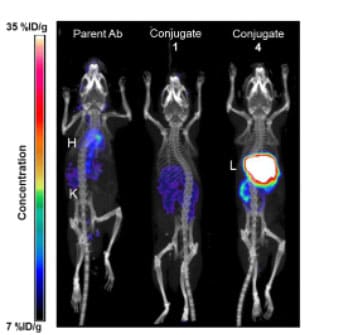
图6. 小鼠静脉给予30-40 mg/kg的64Cu标记偶联物和对照20h后的PET/CT成像[9]
探索二:不同偶联位点的偶联物
进一步探索改变抗体的偶联位点来提高NaV1.7抑制肽偶联物效力,并筛选得到了比E384C具有更高效力的偶联位点,如重链上的T487C和轻链上的D88C,并制备了对应的偶联物5和6(DAR均为2)。与偶联物2相比,偶联物5和6的活性提高了30倍左右,这说明JzTx-V多肽偶联在靠近IgG骨架两端的位点可能可以更好地接触细胞表面的靶离子通道。小鼠PK结果表明,与偶联物2相比,偶联物5和6的血清AUC分别降低了1.9倍和2.3倍。除了半胱氨酸抗体突变位点外,这三种偶联物的化学成分几乎相同,却表现出不同的活性和PK特性。这些偶联物在近7天的时间内维持了高于其体外IC50值的血清浓度。
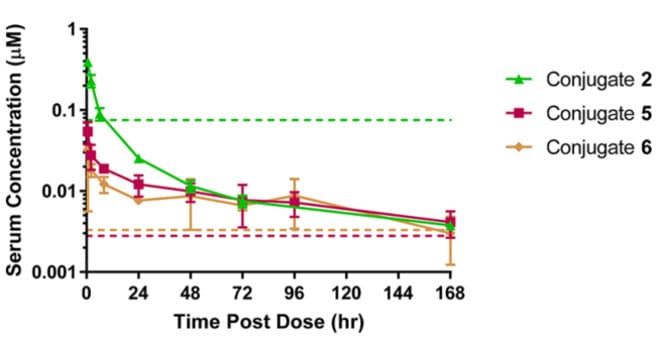
图7. CD-1小鼠静脉给予5 mg/kg偶联物2、5、6后总抗的血清药物浓度时间曲线[9]
探索三:不同等电点(pI)的偶联物
根据前期经验,多肽的等电点(pI)对抗体PK和组织分布有显著影响。因此,研究者假设降低JzTx-V肽类似物的pI,同时保留NaV1.7的效力和选择性,可能会改善偶联物的体内PK特性,增加靶标暴露。通过氨基酸序列调整与修饰,该团队制备了净电荷分别为+3、+4和+2的JzTx-V类似物,对应偶联物7、8和9的hNaV1.7 IC50分别为10.4、3.1和16.4 nM。小鼠PK结果显示,偶联物的暴露量(AUC0-last)与净电荷的增加呈负相关(偶联物9(净电荷+2)>偶联物7(净电荷+3)>偶联物8(净电荷+4)>偶联物6(净电荷+6))。
通过不断优化,采用净电荷+2的JzTx-V肽类似物和甘氨酸-甘氨酸-丝氨酸(GGS)连接子,得到具有高体外效力(IC50=1.6 nM)的JzTx-V肽抗体偶联物10。小鼠PK研究表明,偶联物10的血清暴露量虽然不及带同等电荷的偶联物9,但体外活性较偶联物9增加了10倍。
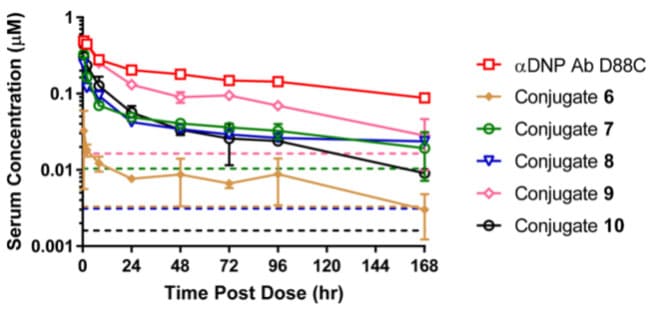
图8. CD-1小鼠静脉给予5 mg/kg偶联物6-9以及裸抗后总抗的血清药物浓度时间曲线[6]
该研究设计一系列抗体-NaV1.7抑制肽偶联物,从连接子、偶联比、偶联位点和多肽等电点等多个角度探索了偶联物的PK和PD特性。尽管目前还未得到具有理想性质的偶联物分子,这些经验对APC研究具有一定的参考价值。
结语
APC药物综合了抗体和多肽药物的优势,能够发挥诸如靶向多个靶点的协同效应、延长多肽药物的半衰期等优点,作为一种新的药物形式代表了药物研发的前沿领域。APC药物在肿瘤和非肿瘤的多个疾病领域正在火热研发中。临床前和临床阶段的管线也正在取得令人鼓舞的结果。APC中不同抗体、多肽和连接子的组合带来了无尽的可能性,但同时也存在着诸多挑战。与传统的单抗和多肽药物相比,APC作为偶联药物,其药代动力学、有效性和安全性的研究内容更为复杂,同时也有着较高的研发难度和成本。随着技术更新和不断探索,相信会有越来越多的有潜力的APC药物被开发。药明康德DMPK部门具备丰富的偶联药物体内外研究经验,可以快速助力药物研发者在不同的研究阶段高效评估APC药物体内/体外的ADME特征,为安全性和临床研究打下坚实的基础。
作者:史新萌,李倩,马利萍,金晶
编辑:钱卉娟
设计:倪德伟,张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系
参考
[1]Véniant MM, Lu SC, Atangan L, et al., A GIPR antagonist conjugated to GLP-1 analogues promotes weight loss with improved metabolic parameters in preclinical and phase 1 settings. Nat Metab. 2024 Feb;6(2):290-303.
[2]Petruzzella A, Bruand M, Santamaria-Martínez A, et al., Antibody-peptide conjugates deliver covalent inhibitors blocking oncogenic cathepsins. Nat Chem Biol. 2024 Sep;20(9):1188-1198.
[3]Tian Z, Yu C, Zhang W, et al., Bone-Specific Enhancement of Antibody Therapy for Breast Cancer Metastasis to Bone. ACS Cent Sci. 2022 Mar 23;8(3):312-321.
[4]Lu SC, Chen M, Atangan L, et al., GIPR antagonist antibodies conjugated to GLP-1 peptide are bispecific molecules that decrease weight in obese mice and monkeys. Cell Rep Med. 2021 Apr 30;2(5):100263.
[5]Zhang M, Lee F, Knize A, et al., Development of an ICOSL and BAFF bispecific inhibitor AMG 570 for systemic lupus erythematosus treatment. Clin Exp Rheumatol. 2019 Nov-Dec;37(6):906-914. Epub 2019 Feb 15. PMID: 30789152.
[6]Abuqayyas L, Chen PW, Dos Santos MT, et al., Pharmacokinetics and Pharmacokinetic/Pharmacodynamic Properties of Rozibafusp Alfa, a Bispecific Inhibitor of BAFF and ICOSL: Analyses of Phase I Clinical Trials. Clin Pharmacol Ther. 2023 Aug;114(2):371-380.
[7]Naing A, Thistlethwaite F, De Vries EGE, et al., CX-072 (pacmilimab), a Probody ® PD-L1 inhibitor, in advanced or recurrent solid tumors (PROCLAIM-CX-072): an open-label dose-finding and first-in-human study. J Immunother Cancer. 2021 Jul;9(7):e002447.
[8]Sanborn RE, Hamid O, de Vries EG, et al., CX-072 (pacmilimab), a Probody PD-L1 inhibitor, in combination with ipilimumab in patients with advanced solid tumors (PROCLAIM-CX-072): a first-in-human, dose-finding study. J Immunother Cancer. 2021 Jul;9(7):e002446.
[9]Murray JK, Wu B, Tegley CM, et al., Engineering NaV1.7 Inhibitory JzTx-V Peptides with a Potency and Basicity Profile Suitable for Antibody Conjugation To Enhance Pharmacokinetics. ACS Chem Biol. 2019 Apr 19;14(4):806-818.
[10]Boustany LM, LaPorte SL, Wong L, et al., A Probody T Cell-Engaging Bispecific Antibody Targeting EGFR and CD3 Inhibits Colon Cancer Growth with Limited Toxicity. Cancer Res. 2022 Nov 15;82(22):4288-4298.
[11]Desnoyers LR, Vasiljeva O, Richardson JH, et al., Tumor-specific activation of an EGFR-targeting probody enhances therapeutic index. Sci Transl Med. 2013 Oct 16;5(207):207ra144.
[12]Camacho RC, You S, D'Aquino KE, et al., Conjugation of a peptide to an antibody engineered with free cysteines dramatically improves half-life and activity. MAbs. 2020 Jan-Dec;12(1):1794687.
[13]Amgen Business Review Meeting. Retrieved February 8, 2022, from http://investors.amgen.com./static-files/6d823d7d-2fd1-405a-8c0e-2aa91bee682
加入订阅
获取药物代谢与药代动力学最新专业内容和信息