尽管多肽药物在美国食品和药品监督管理局(FDA)已批准药物中仅占约2%,但其在某些小分子药物或治疗性抗体无法治疗的疾病中展现出独特优势。然而,多肽易受蛋白酶水解作用影响,存在半衰期短等缺陷。为改善这种情况,肽化学家们引入非天然氨基酸和化学修饰来增强它们的代谢稳定性。早先,GLP-1类疗法的设计面临一个核心挑战——天然GLP-1分子在短短几分钟内就会被体内的环境降解。因此,科学家优化设计GLP-1类似物,从而大大延长药物在体内的半衰期。比如,司美格鲁肽的半衰期经过优化提升至165小时,每周只需注射一次就能起到治疗效果。这一优化不仅依赖于氨基酸修饰和分子结构设计,还包括通过脂质修饰增强与血浆蛋白(如白蛋白)的结合,从而减少肾脏清除并延长药物在体内的存在时间。因此,深入了解多肽药物如何被组织中酶代谢将有助于设计更稳定的多肽药物。
本文系统阐述了多肽在胃肠道、肝脏、肾脏及循环系统中的体外代谢研究方法,通过整合不同结构类型与分子量范围的商品化多肽药物,对比解析多组织间的代谢差异,希望可以为多肽药物的研发提供指导。
多肽药物研发面临的挑战
药物代谢对药物的药理学和安全性有较大影响,虽然多肽药物和小分子药物遵循相同的药代动力学和代谢原理,却存在显著的代谢差异。低分子量的化合物主要由细胞色素P450酶(CYP450)代谢为非活性和活性代谢物,而大多数的肽则由蛋白酶代谢为氨基酸[2,3],使其面临代谢稳定性差、分子量大、不易跨越膜屏障等挑战,限制了多肽药物的广泛应用[1]。因此在药物开发过程中表征肽代谢酶极其重要。蛋白质水解在体内,尤其是胃肠道中广泛发生,需要表征在胃肠道、肝脏、肾脏和血浆中潜在降解多肽的酶。本文着重介绍多肽在胃肠道、肝脏、肾脏和血浆的体外实验体系的研究方法和数据对比。
多肽体外各个组织代谢体系研究
我们选择了具有不同分子量的5个商品化多肽药物,包含线性肽和环肽两种类型。如下表所示。
表1. 5个商品化多肽的信息
英文名 | 中文名 | MW | FW | 类型 |
Somatostatin Acetate | 生长抑素 | 1637.88 | 1637.88 | 环肽 |
Deslorelin Acetate | 德舍瑞林 | 1282.47 | 1282.47 | 线性肽 |
Octreotide Acetate | 奥曲肽 | 1019.24 | 1019.24 | 环肽 |
Semaglutide | 司美格鲁肽 | 4113.64 | 4113.64 | 线性肽(脂肪链) |
Liraglutide | 利拉鲁肽 | 3751.2 | 3751.2 | 线性肽(脂肪链) |
多肽在血浆中的代谢研究
血浆的易获取性使之成为体外药物代谢研究的首选基质。在血浆制备中,为防止血液凝固需要加入抗凝剂,但ETDA-K2抗凝剂会对血浆中某些酶活产生影响,新鲜和冷冻血浆中酶活性存在一定差异,所以针对多肽,我们选择快、中、慢代谢的三个药物,对不同条件进行对比,分别为:
肝素钠抗凝和EDTA-K2抗凝剂;
新鲜采集血浆和冷冻保存血浆;
血浆和血清。
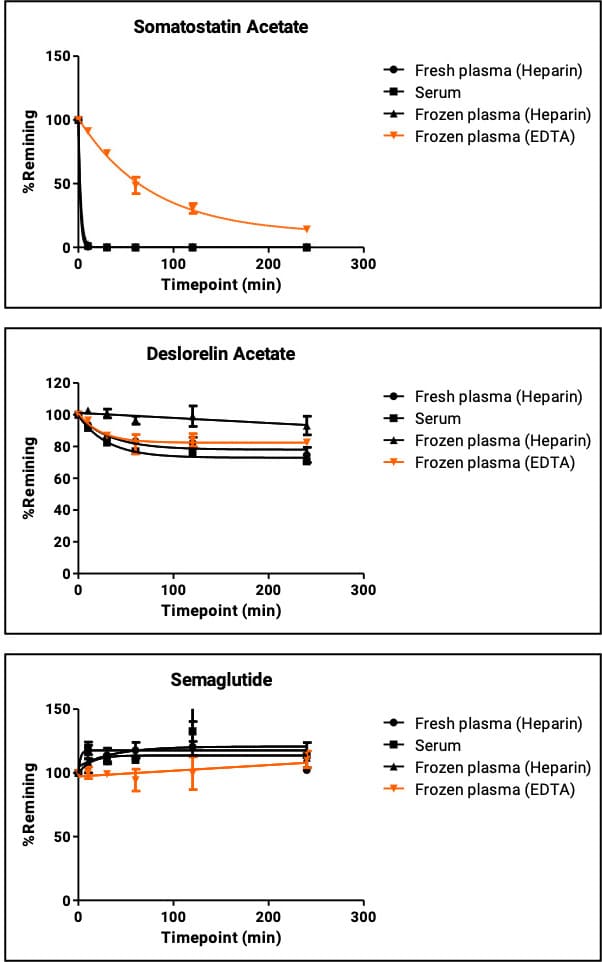
图1. 3个化合物在不同条件血浆下代谢数据
从图1可以观察到,中等和慢代谢化合物在以上三个条件中基本无差异,但快代谢化合物生长抑素在EDTA-K2抗凝的血浆中的代谢明显慢于肝素钠抗凝的血浆。综上所述,对于多肽的研究可以优先考虑肝素钠抗凝的冷冻血浆。当然涉及到全血的研究,抗凝剂的选择和血浆一致,优先考虑肝素钠作为抗凝剂。
多肽在胃肠道的代谢研究
大部分多肽药物以静脉注射、皮下注射等给药方式为主,较少采用口服给药,这是因为胃肠道含有大量蛋白酶,会迅速水解多肽,破坏其结构。此外,多肽渗透性低,影响吸收。而诺和诺德研发的口服制剂司美格鲁肽在2019年被FDA批准,大大提高了患者的依从性和便利性,其口服制剂是和SNAC { N-[8-(2-羟基苯甲酰基)氨基]辛酸盐,一种公认安全的小分子吸收促进剂} 一起构成的复方制剂,主要在胃部进行吸收。
胃肠道中代谢多肽的酶主要包含胃蛋白酶(pepsin)、胰蛋白酶(trypsin)、胰酶(pancreatin)、糜蛋白酶(chymotrypsin)、弹性蛋白酶(elastase)等。药明康德DMPK既有人工模拟胃肠液实验体系,也有针对如上单一酶的实验体系,用于体外评估多肽在胃肠液中的稳定性。
我们选择12个商品化多肽进行胃肠道中酶(胃蛋白酶、胰蛋白酶、胰酶、糜蛋白酶、弹性蛋白酶)的研究,其数据见表2,其中Cyclosporine和Nafarelin与文献结果一致,证明了体系的可靠性。
表2. 商品化多肽在胃肠道中酶的半衰期
Compound ID | T1/2 (min) | Literature Description | ||||
Chymotrypsin | Trypsin | Pancreatin | Pepsin | Elastase | ||
Cetrorelix | 390.7 | >578.1 | 62.1 | >578.1 | >578.1 | / |
Cyclosporine | >578.1 | >578.1 | >578.1 | >578.1 | >578.1 | As a cyclic peptide, cyclosporine is highly stable towards gastrointestinal peptidases (> 90% intact after 2 h incubation) |
Daptomycin | >578.1 | >578.1 | >578.1 | >578.1 | >578.1 | / |
Degarelix | >578.1 | >578.1 | >578.1 | >578.1 | >578.1 | / |
Eptifbatide | >578.1 | >578.1 | >578.1 | >578.1 | >578.1 | / |
Icatibant | 33.9 | 159.0 | 240.7 | >578.1 | >578.1 | / |
Nafarelin | 2.1 | 5.8 | 1.4 | >578.1 | 10.0 | In vitro experiments revealed it to be surprisingly stable towards human gastric peptidases (~ 90% intact after 2 h incubation) but is rapidly hydrolyzed by intestinal peptidases (0% intact within 5 min), |
Somatostatin Acetate | <5.0 | 4.2 | <5.0 | >578.1 | 1.8 | / |
Deslorelin Acetate | 12.5 | 6.0 | 1.9 | >578.1 | >578.1 | / |
Semaglutide | <5.0 | 9.3 | 7.9 | 60.1 | 2.4 | / |
Liraglutide | <5.0 | 2.5 | 7.4 | >578.1 | <7.5 | / |
多肽在肝组织不同研究体系的代谢
肝脏含有丰富的药物代谢酶,在药物代谢中起着至关重要的作用。肝脏中多种研究体系的对比如表3所示。
表3. 体外肝脏代谢体系的比较
体系 | 优点 | 不足 | 多肽适用体系推荐 |
肝微粒体 | CYP酶含量丰富且酶活性高 | 缺乏细胞结构 | × |
肝S9 | 含有多种蛋白酶和水解酶 | 缺乏细胞结构,不能反映细胞内的代谢环境 | √ |
肝细胞 | 保留了肝细胞的代谢功能和细胞结构,能反映药物的多种代谢途径 | 不适合膜通透性差的分子 | √ |
肝匀浆 | 代谢酶种类齐全,适用于全面的代谢研究 | 由于包含非特异性成分,可能导致背景噪声较高 | √ |
多肽在各个体系中的代谢情况如图2所示,可以明显看出5个化合物在人和大鼠肝S9中的代谢清除高于或者类似于其他体系,同时肝S9的半衰期数据和体内的结果相关性最好。Juha Jyrkäs[5]在其2021年发表的文章中通过4个商品化多肽(cyclosporine A, leuprorelin, desmopressin, and cetrorelix)作为模型,对比其在肝S9、肝细胞和Upcyte肝细胞(利用upcyte技术进行细胞扩增,从原代肝细胞中扩增得到的细胞系)的代谢及其代谢产物的数量,结论依旧是肝S9中有最高的清除及最多的代谢产物,可以作为多肽研究的优选体系。
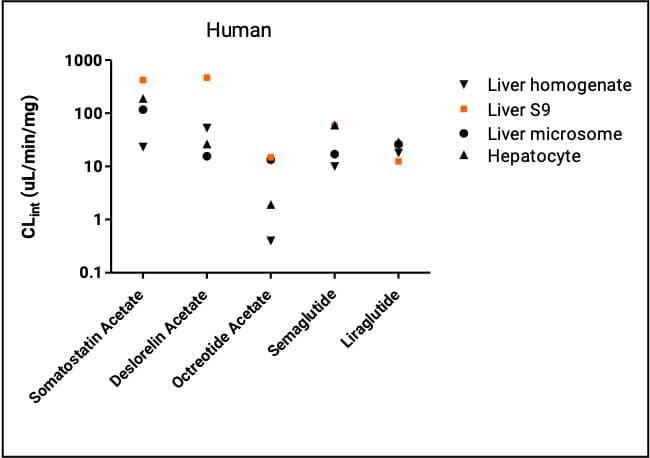
图2. 5个多肽药物在人种属不同测试体系中清除率数据
表4. 体外和体内半衰期数据相关性
Compound ID | T1/2 (min) | Literature Description [4] | ||
Liver S9 | Hepatocyte | Liver homogenate | ||
Somatostatin Acetate | 1.6 | 7.3 | <30 | 2 to 3 min for somatostatin |
Octreotide Acetate | 46.9 | >720.0 | >3468 | When administered intravenously or subcutaneously, octreotide has a plasma half-life of 1.7 to 1.9 h, Octreotide is primarily metabolized in the liver |
多肽在肾脏不同体系的代谢研究
体外肾脏代谢的主要测试体系有肾微粒体、肾S9和肾匀浆。考虑到肾微粒体的代谢酶主要针对小分子药物,此处展示多肽药物在肾S9和肾匀浆测试体系下的数据对比,如图3所示,与肝脏类似,5个多肽药物在肾S9中的代谢清除率均高于或类似于其在肾匀浆中的数据。Juha Jyrkäs[6]在其2023年发表的文章中,通过对比环孢素A、亮丙瑞林和塞曲瑞克(cyclosporine A, leuprorelin, and cetrorelix)三种商品化多肽药物在肾脏和肠中的代谢情况,发现亚细胞S9组分是代谢清除最快的体系。该研究表明,肾S9可以作为研究肝外组织中多肽药物代谢的优选体系。

图3. 5个多肽药物在人种属不同测试体系中的清除率数据
通过以上体外代谢平台的介绍,可以根据不同给药方式选择更加合理的评估体系,进而根据其代谢数据进行多肽的修饰以增加其稳定性。一般来说可以通过N端或者C端修饰,一些非天然氨基酸替代天然氨基酸、环化,添加脂肪链等方式增加多肽的稳定性。
上市多肽药物代谢稳定性分享
在文章“A Review on the Metabolism of 25 Peptide Drugs”中提到[4],FDA批准的25种多肽药物中,为延长它们的系统半衰期,有20种含有非天然氨基酸残基。在这20个肽中,19个涉及d-氨基酸取代,16个涉及N或C端修饰,以防止内源性外肽酶。但也有一些特例,比如下面案例种依卡替班(Icatibant)即使引入5个非天然氨基酸,仍然有较短的半衰期。
Icatibant作为一种缓激肽B2受体拮抗剂,通过阻断缓激肽的作用,有效缓解遗传性血管性水肿(HAE)急性发作的症状,其代谢主要依赖于肽酶的作用。然而,即使在肽序列中加入了5个非天然氨基酸,它在皮下给药后仍具有相对较短的消除半衰期,为1至1.8小时(Hide et al. 2020),并被血浆和肝脏肽酶广泛代谢为两种无活性代谢物,由肾脏排出。Icatibant在各个单一酶的代谢如图5所示,因都有比较快的代谢,其给药方式选择皮下注射,可以被迅速吸收入血,血浆浓度升高。
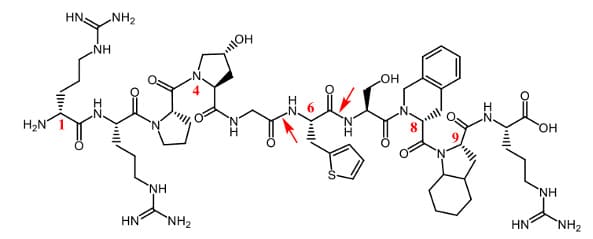
图4. Icatibant结构[4],红色数字表示非天然氨基酸残基,红色箭头表示报道的内源性肽酶裂解位点
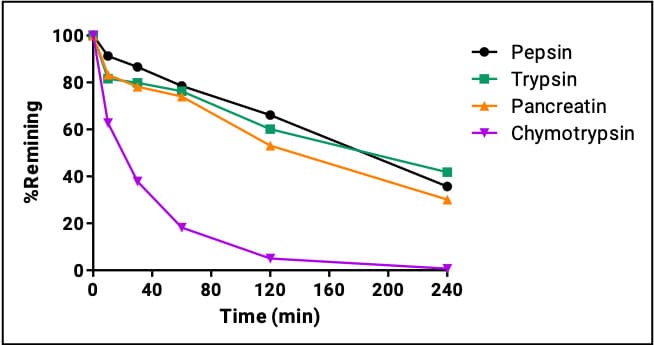
图5. Icatibant在四个胃肠道酶的代谢数据
达托霉素(Daptomycin)是一种环状脂肽抗生素,化学结构由13个氨基酸残基(包含7个非天然氨基酸)组成的环状多肽和一个癸酰基侧链组成。其用于复杂皮肤和皮肤结构感染(cSSSI)、金黄色葡萄球菌血流感染(包括右心感染性心内膜炎)和其他由耐药革兰氏阳性菌引起的严重感染。它的血浆半衰期为6.6至8.8小时,每天静脉注射一次(2011年包装说明书),其较长的半衰期是由于高血浆蛋白结合(90-95%)导致肾小球滤过受限,因此适合每日一次给药。Daptomycin在各个胃肠道单一酶的代谢如图7所示,因有非天然氨基酸的加入,其不易受到胃肠道酶的影响,增加其稳定性。
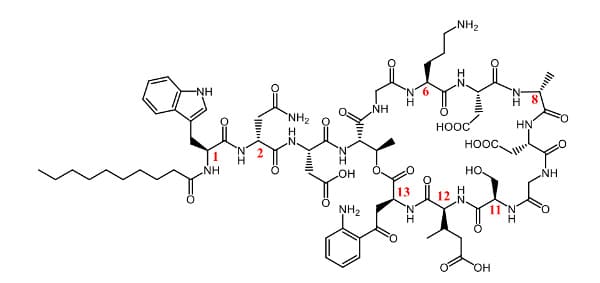
图6. Daptomycin结构[4]。红色数字表示非天然氨基酸残基
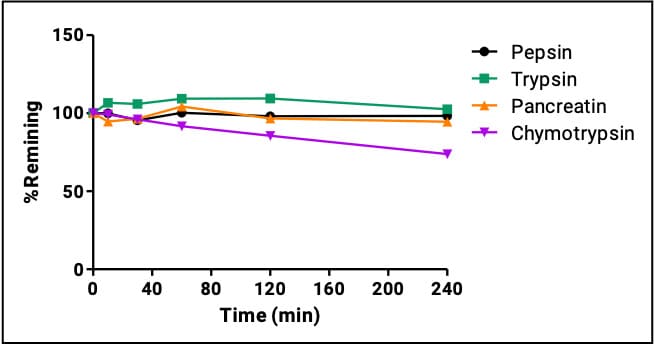
图7. Daptomycin在四个胃肠道酶的代谢数据
结语
多肽药物相对于小分子药物具有更高的活性和更强的选择性,在治疗复杂疾病方面优势明显,相对于蛋白质药物,多肽药物具有稳定性好、纯度高、免疫原性低等优势。药明康德DMPK针对多肽的筛选、PCC、IND等不同研发阶段均有对应的稳定性研究策略,建立了完善的多肽成药性评价体系,包含循环系统、胃肠道、肝脏和肾脏的稳定性研究,赋能客户一站式、高效的研究解决方案。
作者:徐振古,刘海娟,王翔凌,陈根富
编辑:富罗娜·克里木,钱卉娟
设计:倪德伟,张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系。
参考
[1] Lau JL, Dunn MK (2018) Therapeutic peptides: historical perspectives, current development trends, and future directions. Bioorg Med Chem 26(1):2700–2707
[2] M. Werle, (2006) Strategies to improve plasma half life time of peptide and protein drugs. Amino Acids. 30: 351–367
[3] Jin-Feng Yao, Hong Yang, (2018) Metabolism of Peptide Drugs and Strategies to Improve their Metabolic Stability. Current Drug Metabolism. 19: 892-901
[4] C. S. Brian Chia (2021), A Review on the Metabolism of 25 Peptide Drugs. International Journal of Peptide Research and Therapeutics. 27:1397–1418
[5] Juha Jyrkäs, (2021) Hepatic in vitro metabolism of peptides; Comparison of human liver S9, hepatocytes and Upcyte hepatocytes with cyclosporine A, leuprorelin, desmopressin and cetrorelix as model compoundsJournal of Pharmaceutical and Biomedical Analysis. 196: 113921
[6] Juha Jyrkäs, (2023) Extrahepatic in vitro metabolism of peptides; comparison of human kidney and intestinal S9 fraction, human plasma and proximal tubule cells, using cyclosporine A, leuprorelin, and cetrorelix as model compounds. Journal of Pharmaceutical and Biomedical Analysis. 225: 115219
加入订阅
获取药物代谢与药代动力学最新专业内容和信息














