早在1854年,苏格兰化学家Thomas Graham首先提出了“透析”(Dialysis)这个概念。随着科学家们不断的发明创造,在20世纪70年代研究者将灌注技术和透析技术结合起来,从而诞生“微透析”这一概念[1,2],使该技术得到了进一步发展,至今已经成为国际前沿研究体内内源性、外源性化学物质浓度变化及组织细胞代谢、细胞因子和介质排泄状况的取样技术,并在超过18,000篇文章中作为一种药物研究和开发工具来使用。本文将介绍微透析技术(Microdialysis,MD)的原理和特点,案例分享以及在药代动力学研究中的应用。
一、微透析技术介绍
长期以来,药物研究在体内项目中取样主要采用取血和组织匀浆的方式,然而传统的取样方式无法真实地反映细胞外液中真正发挥作用的游离药物浓度,无法在不损失生物体体液的情况下取样,不能动态捕捉到药物在体内瞬时变化的全过程,从而无法进行自身对照。相较于传统组织采集匀浆的方式,微透析技术可在基本不干扰生物体生命条件的情况下,对靶部位细胞外液中游离内源、外源性目标分子进行在体、实时和在线取样。
微透析技术是一项可靠的体内检测工具,可用于在线测定动物和人体内几乎每一个特定的组织和器官间质药物浓度,也是目前唯一一项可以提供体内细胞外液游离药物浓度数据的技术,同时该技术具有定量特性。如图1,将具有透析作用的微探针置于待采样的生物组织内,以恒定的流速将灌注液泵入内部管道,在存在浓度差的条件下,游离药物通过透析膜进入探针内,并被连续流动的灌注液不断带出,即可得到特定区域中目标物质的准确含量[3]。
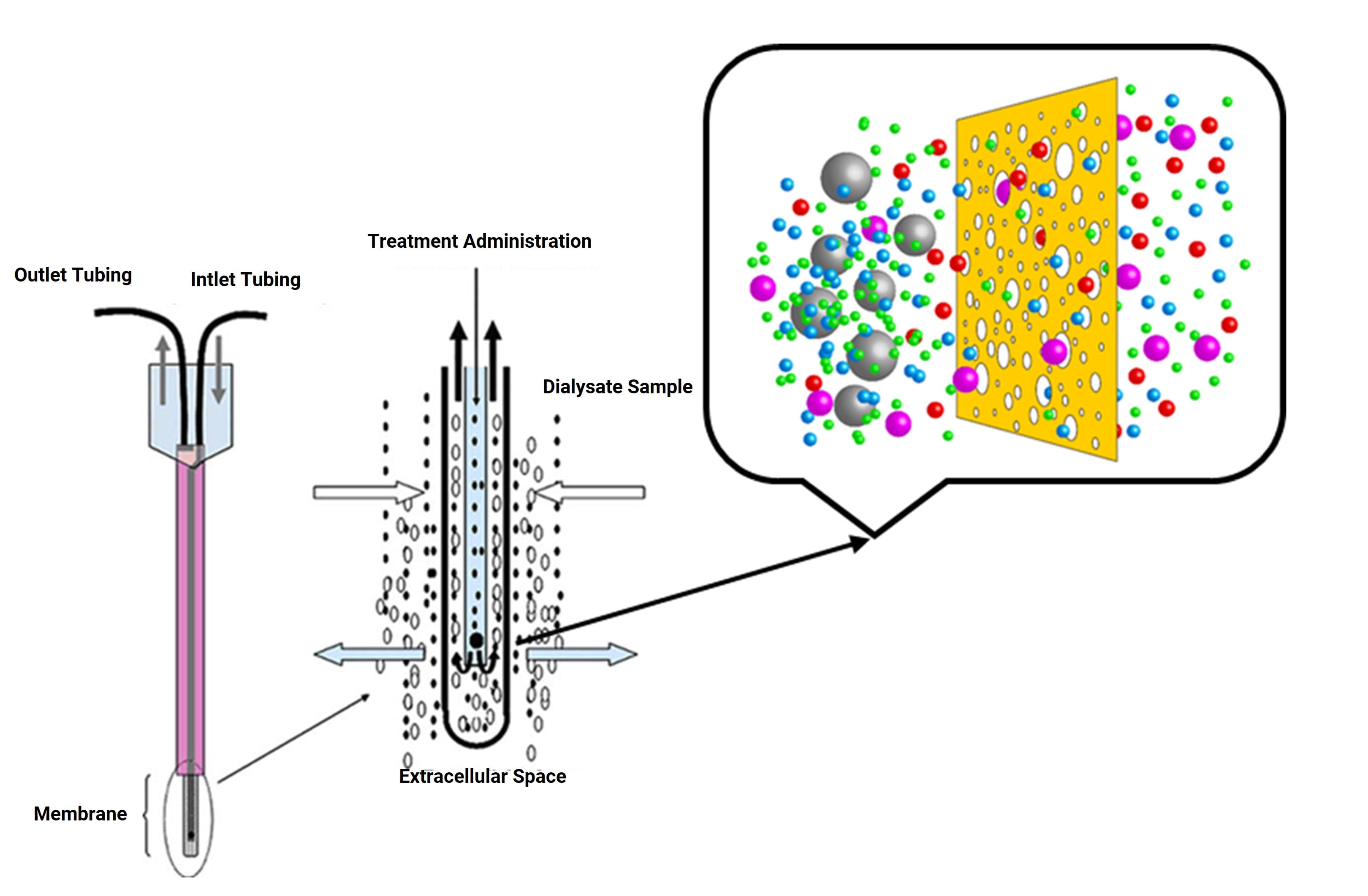
图1.微透析技术原理示意图[4]
微透析技术在体内药代动力学(PK)研究中,可用于游离药物浓度检测,跨血脑屏障(BBB)药物的分布乃至药物在体的整个吸收、分布、代谢和排泄(ADME)过程。在药理学(PD)研究中,可使用微透析连续采样、定点采样及多位点同时采样等特点,用于研究体内游离药物浓度及生物标记物(Biomarker)的检测。与此同时,还可以同步进行PK与PD的研究,助力药物在体内的分布及药效评价的研究[5-8]。
二、微透析装置
微透析系统装置如图2所示,主要由微量泵、微透析探头、收集器、连接管路及配套设备组成。微透析技术的核心部位是探针,目前市面上探针类型主要包括:同心圆探针、线性探针和环型探针等多种的类型。应用较广泛的是同心圆探针,其结构类似于毛细血管,导管由一根入口管、出口管及引入组织内部的轴和尖端器皿组成,带有半透膜(白色)尖端器皿为组织间隙中游离药物和探针液体进行交换的场所(如图1)。其中,同心圆探针多用于脑部和血液;线性探针多用于外周组织,例如皮肤、眼睛和肌肉等组织(如图3)。

图2.微透析仪器装置示意图
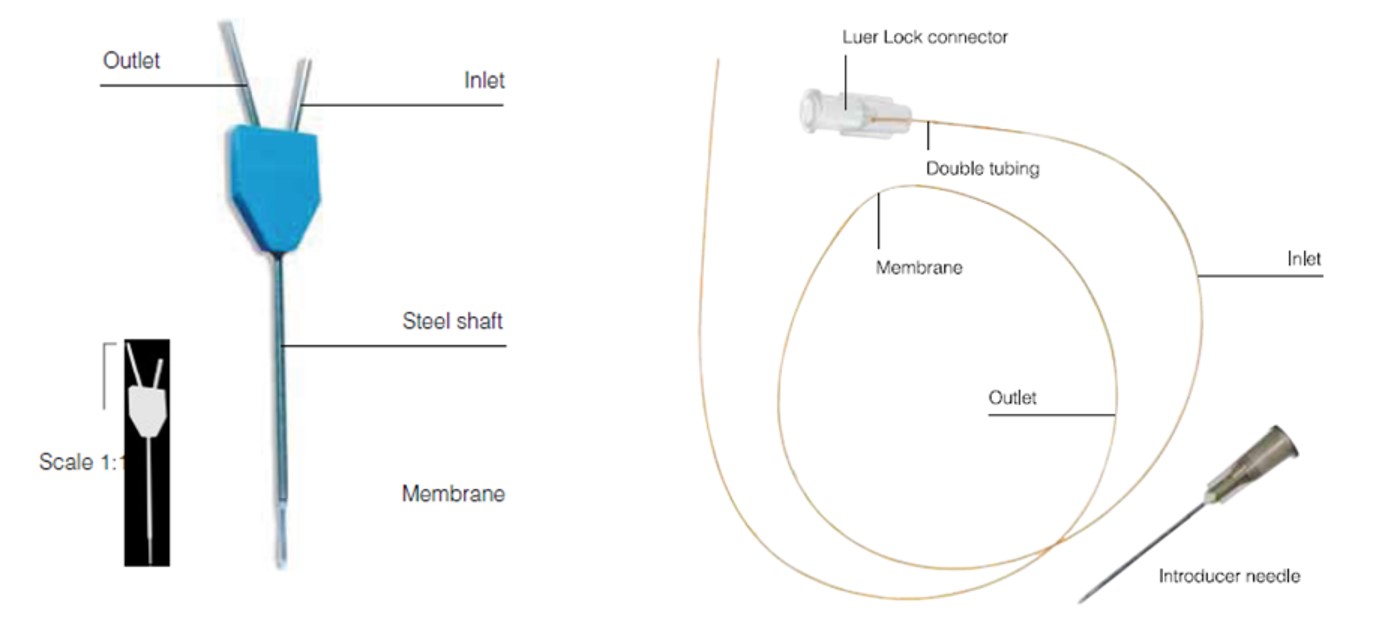
图3.微透析探针示意图
三、微透析应用
到目前为止,微透析技术可以用于各种组织在临床前的研究,相关监管机构也鼓励研发者在临床前和早期临床阶段使用该新技术。与此同时,微透析技术可以作为一项对靶组织直接取样的技术用于生物等效性(BE)的评估[9]。微透析技术已逐步标准化,并从实验室走向广泛的临床研究中。
本平台现已拥有脑、血管、皮肤和肾等微透析研究能力,其中脑和皮肤是在动物清醒状态下进行,其余组织器官的实验均是在动物麻醉状态下进行(如图4)。
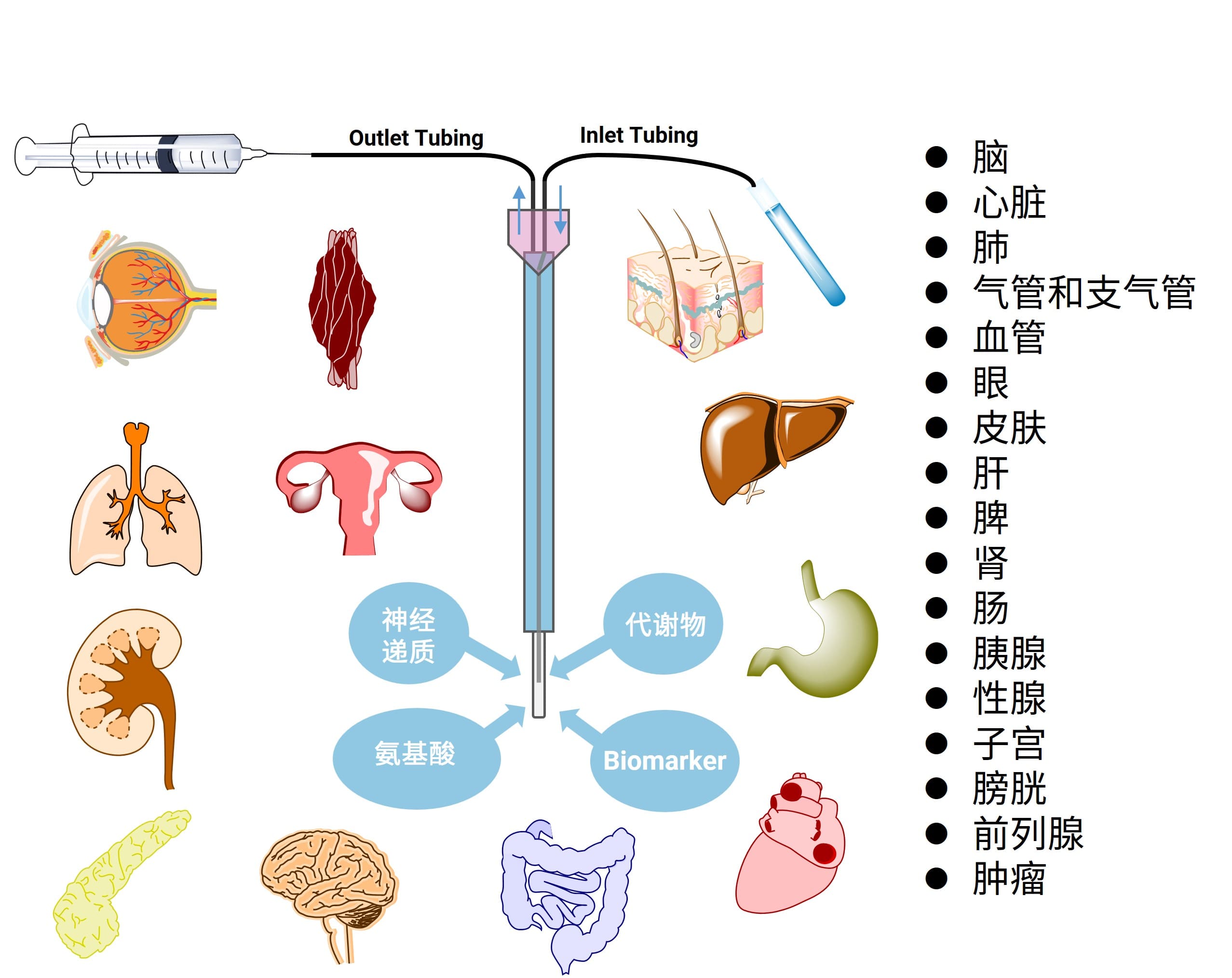
图4.微透析技术应用示意图
四、微透系案例分享
脑微透析
大脑是机体内最重要的组织器官,通过存在于脑内的特殊屏障来抵御体循环中有害物质的侵袭,其屏障主要包括:血-脑屏障、血-脑脊液屏障和脑脊液-脑组织屏障(如图5);通常认为血脑屏障阻碍了中枢神经系统(CNS)药物在脑内的充分分布,导致药效不足;然而,这并不是唯一的原因,除了血脑屏障运输以外,其他因素(比如血浆蛋白结合、血-脑脊液屏障转运和脑脊液周转等)也影响未结合药物在脑内靶位点的浓度-时间分布[10]。
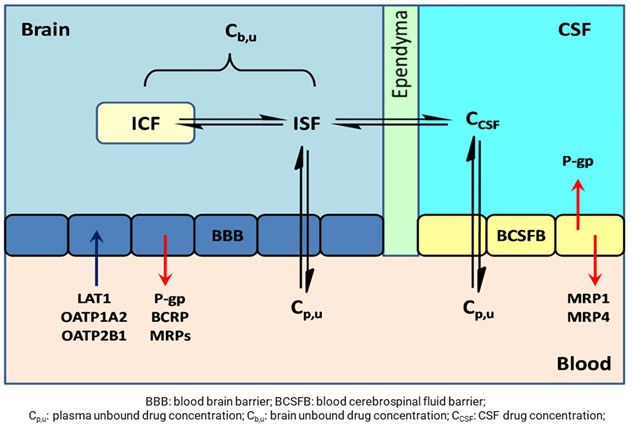
图5. 血液、大脑和脑脊液药物平衡示意图
在药代动力学的研究中,Kp,uu是测定药物在脑内分布的重要参数[11]。Kp,uu是脑间质液与血液中的游离药物浓度比,用于直接衡量所研究药物体内转运的作用,评估化合物脑渗透潜力,以及是否达到血液和脑隔室之间的分布平衡(如表1)。
表1. 药物在体内转运情况评估
Kp,uu≈1 | Cb,u≈Cp,u | 有效流出物和吸收物相互抵消,被动转运占主导。 血浆和脑中的游离药物浓度达到平衡,可以用血浆中的游离药物浓度反映脑内的游离药物浓度。 |
Kp,uu>1 | Cb,u>Cp,u | 药物主动摄取为主。 可能有BBB摄取转运体的参与。 |
Kp,uu<1 | Cb,u<Cp,u | 药物外排为主。 可能存在BBB外排作用或者化合物BBB渗透性差。 |
在常规实验中,多以脑脊液(CSF)中药物浓度代替脑中游离药物浓度,因其具有通量高,成本低等优势。但并不是所有的药物均可适用,当药物是外排转运体底物时,CSF内游离药物浓度会导致脑内游离药物浓度被不同程度的高估或低估。将微透析技术应用于CNS药物研究中,它可以监测脑中化合物浓度随时间变化,同时可以从同一动物中同时获得一系列血样,对于阐明血浆PK和靶区浓度间关系有重要价值。
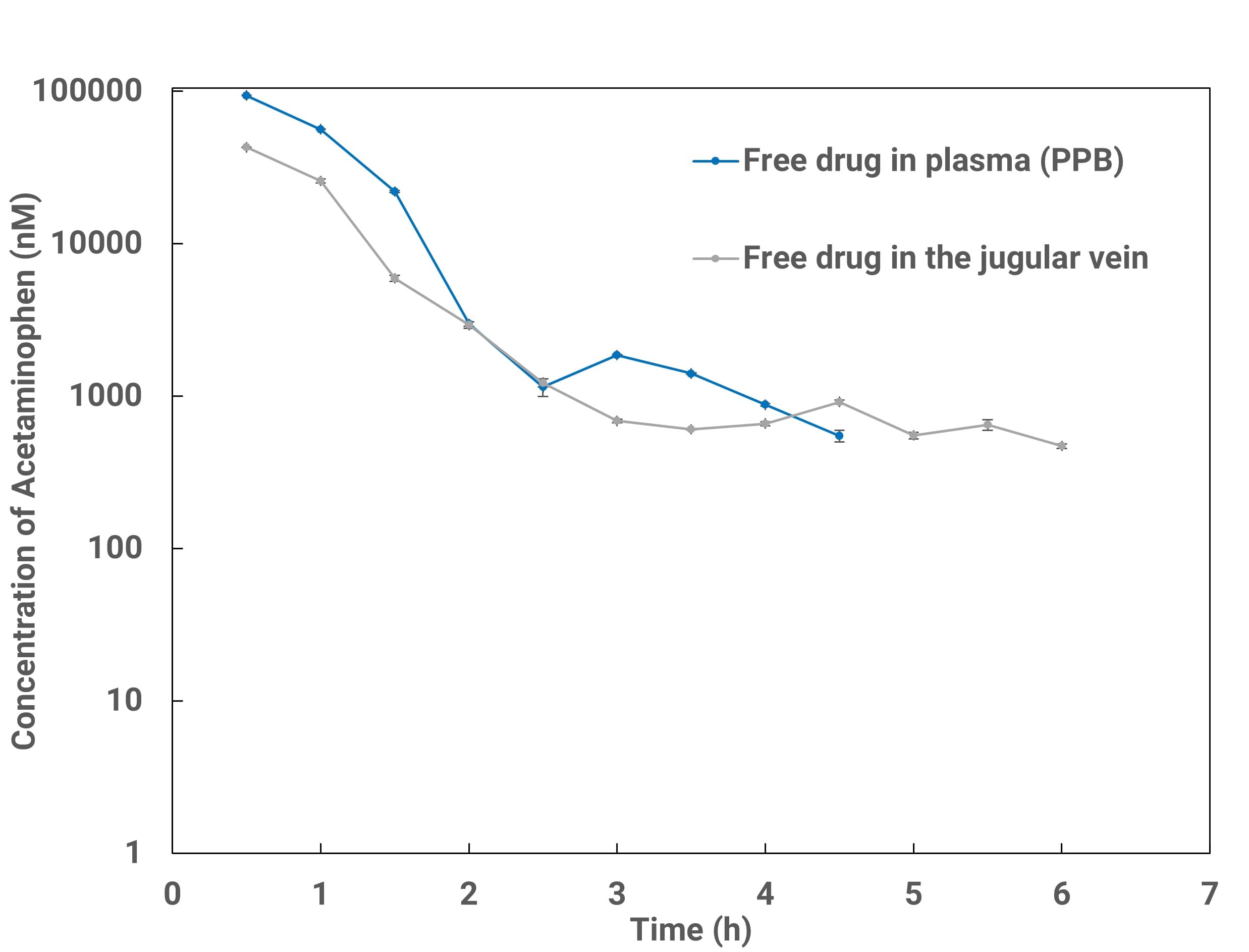
图6. 体内外结合法与微透析法检测血内游离药物浓度
如图6所示,从体内外结合法与微透析法检测血液游离药物浓度验证实验结果表明,使用透析技术作为新型取样方式获得的数据具有可靠性。采用脑微透析与静脉插管(血液)微透析相结合,实现同一只动物多位点同时插管,可直接获得脑脊液与血液中游离药物浓度、AUC与Kp,uu等相关参数(如图7-图9)[12-14]。与此同时,在脑微透析的相关研究中,本平台除了可以对化合物跨血脑屏障的能力进行评价,同时可实现脑内神经递质浓度变化的监测,完成对药物药动学和药效学的同步评价。
图7. 脑微透析示意图[14]
图8. 静脉插管(血液)微透析示意图[15]
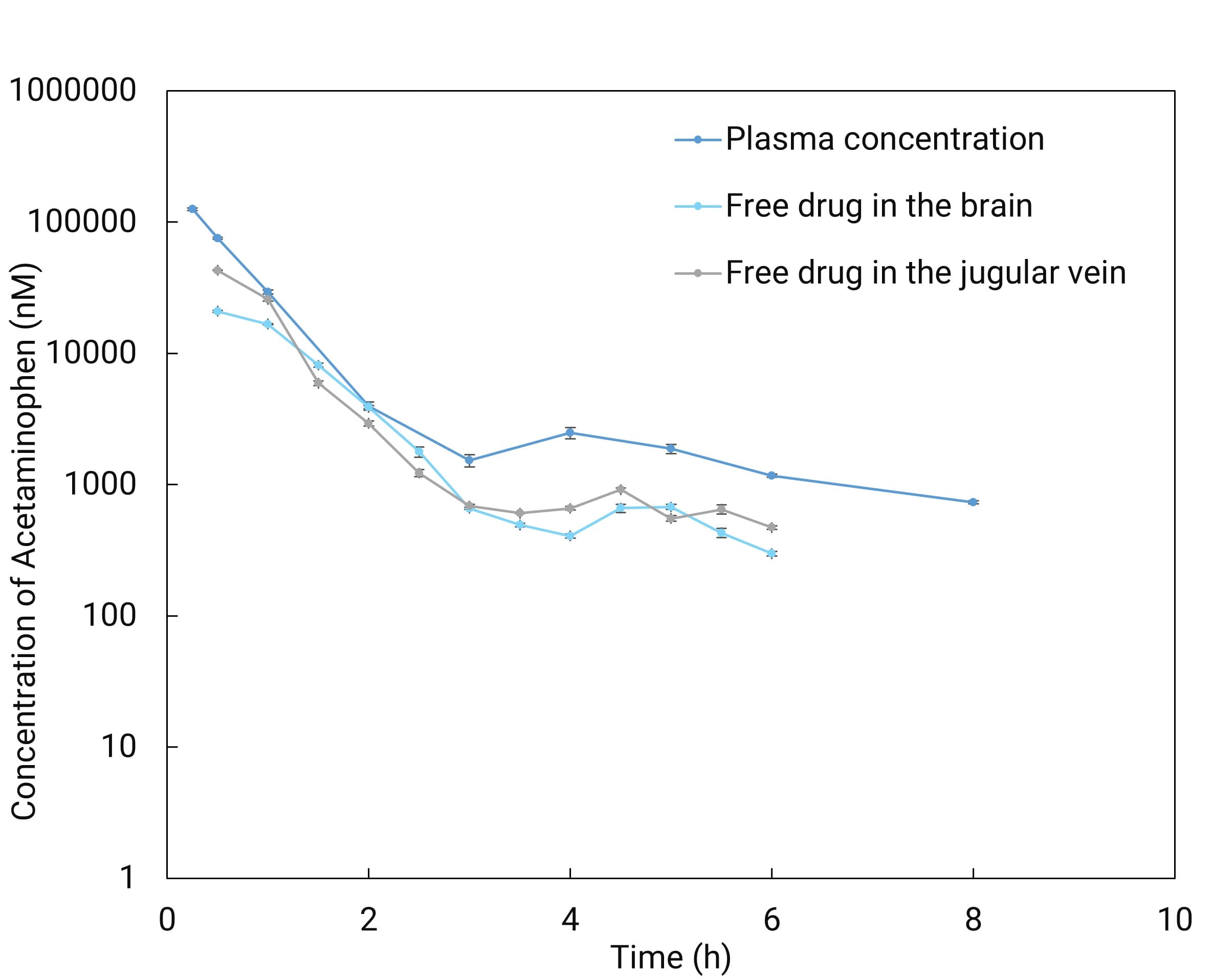
图9. 脑微透析与静脉插管(血液)微透析联用验证数据
皮肤微透析
从临床微透析研究中获得的最新发现表明,对抗菌药物的药代动力学评价很大程度上是基于血浆总浓度的测量,作为抗菌效果的不充分的替代标记物,测量感染部位间质液中游离药物浓度被视为改进抗菌治疗和剂量调整的金标准[16-18]。
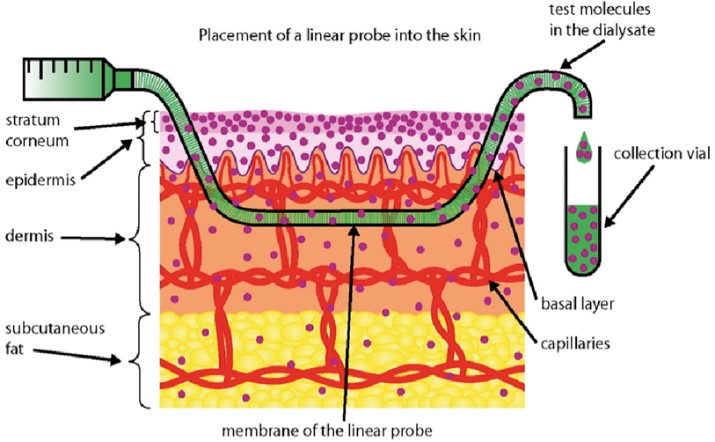
图10. 皮肤微透析示意图[19]
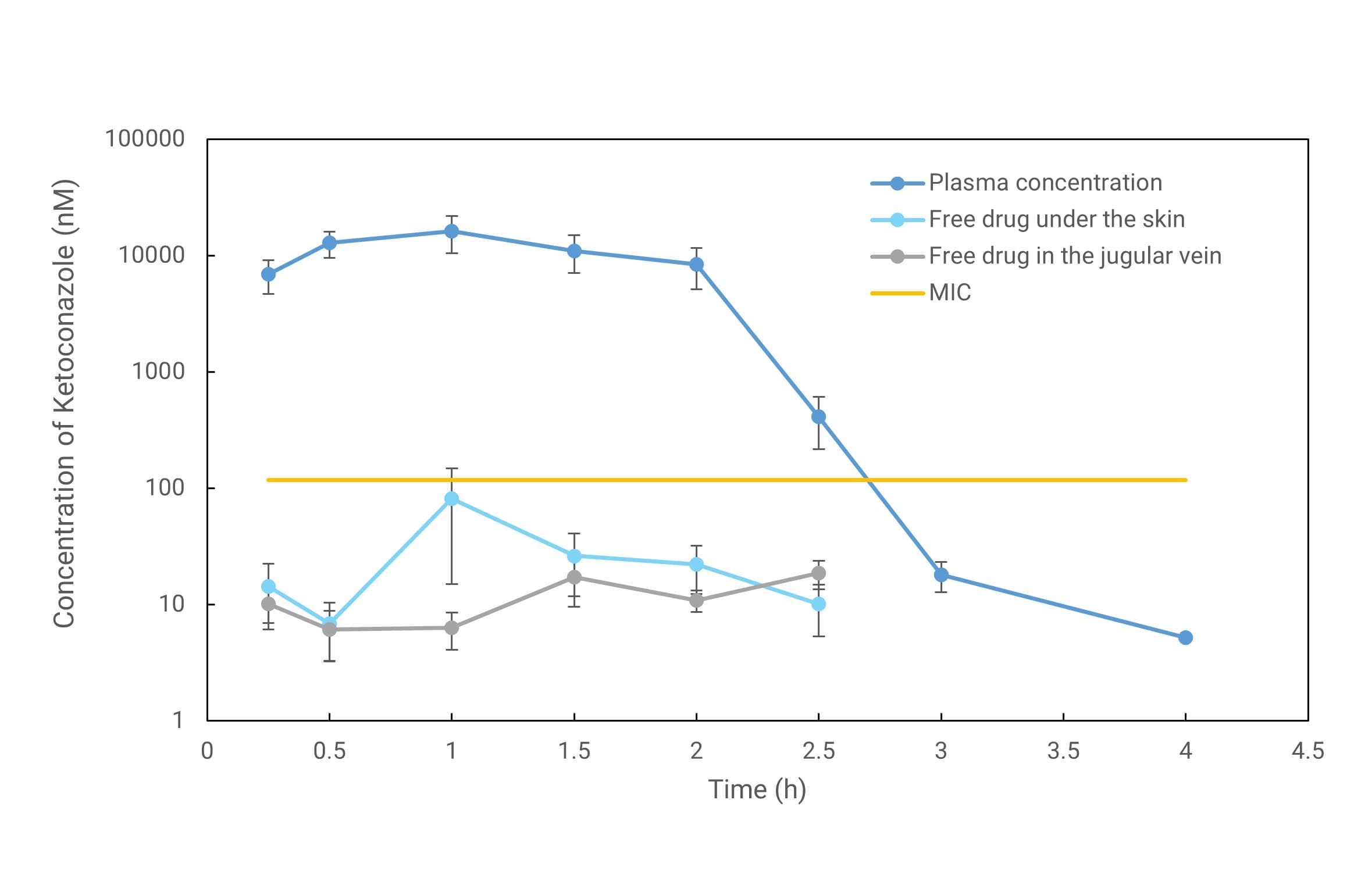
图11. 皮肤微透析与体外抑菌测试结果
如图10和图11所示验证实验采用皮肤微透析、血管微透析与文献中最小抑菌浓度(MIC)测试结果相结合,在获得皮下游离药物浓度变化以外,同时可获得药物抑菌的起效时间和有效范围[20]。药明康德DMPK已成功搭建皮肤微透析平台,并根据CDE要求完成相关NDA申报。
肾微透析
肾排泄是许多药物的主要消除途径。水溶性药物、分子量小的药物以及肝生物转化慢的药物主要经由肾排泄消除,药物的排泄与药效、药效维持时间及药物毒副作用等密切相关[21, 22]。采用常规的组织匀浆法,对于肾器官而言,会额外引入尿液中游离药物,从而导致实际测试的目标位置的浓度与实际值产生偏差。采用微透析技术可直接进行肾皮质药物浓度的测试,更加真实的反映目标位置的待测物浓度(如图12)。本平台已完成了化合物肾毒性发生机制的验证,同时考察了转运体抑制剂对待测物在肾间质渗透液中暴露量影响的相关研究。
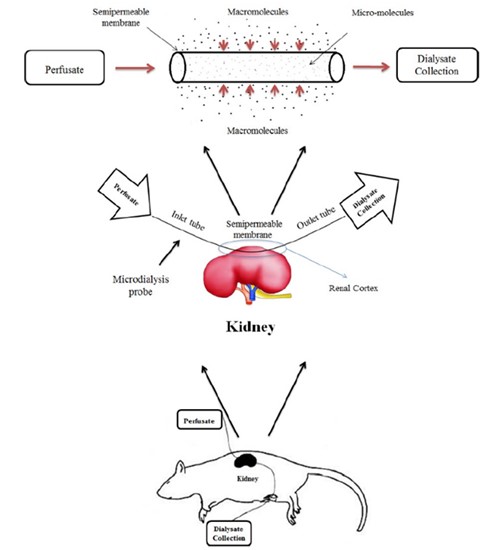
图12. 肾微透析示意图[23]
展望与挑战
现今所处的后基因组时代,蛋白质的结构、功能、浓度和分布受到越来越高的关注。为了更清楚地了解在局部组织水平上人类疾病的发生和发展的潜在机制,有必要深入了解这些蛋白质在时间和空间生成或出现的规律。传统微透析膜孔径为20kD,小于3kD待测物很容易扩散。然而,关于“大”分子量化合物检测(即分子量大于3kD的药物和亲脂性化合物),尽管可用分子截留值>100kD或更大截留值的膜孔径,但技术难度随膜孔径和亲脂性的增加而增加[14]。因此,对于不同的目标待测物,应制定不同的实验策略,尽可能的规避因管路吸附及膜孔不适用等因素导致的实验偏差,以提高测定靶组织待测物测试浓度的准确度和可信度。
结语
在新药研发中,微透析技术是一项非常有价值的工具。通过该技术可实现对待检测靶组织内游离药物进行药代动力学评价。同时,微透析技术不仅可以作为一种检测手段,也可作为一种局部给药工具,用于推动新药研发的创新研究。药明康德DMPK已经成功的搭建了微透析测试平台,具备良好的实验基础,可开展测定药物在不同组织器官目标位置的游离药物浓度,对其进行药代动力学等相关研究。
作者:焦桴荣,董轩,汤城
编辑:方健,钱卉娟
设计:倪德伟
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系。
参考
[1] Ungerstedt U, Pycock C. Functional correlates of dopamine neurotransmission. Bull Schweiz Akad Med Wiss. 1974;30(1-3):44-55.
[2] Ungerstedt U. Microdialysis--principles and applications for studies in animals and man. J Intern Med. 1991;230(4):365-373.
[3] Muller M, et al. Microdialysis in Drug Development, AAPS Advances in the Pharmaceutical
Sciences Series. New York, NY: Springer; 2013.
[4] Chaurasia CS, Müller M, Bashaw ED, et al. AAPS-FDA workshop white paper: microdialysis principles, application, and regulatory perspectives. J Clin Pharmacol. 2007;47:589-603.
[5] Höcht C, Opezzo JA, Taira CA. Microdialysis in drug discovery. Curr Drug Discov Technol. 2004;1(4):269-285.
[6] Wang X, Stenken JA. Microdialysis sampling membrane performance during in vitro macromolecule collection. Anal Chem. 2006;78(17):6026-6034.
[7] Höcht C, Opezzo JA, Bramuglia GF, Taira CA. Application of microdialysis in clinical pharmacology. Curr Clin Pharmacol. 2006;1(2):163-183.
[8] Lionberger RA. FDA critical path initiatives: opportunities for generic drug development. AAPS J. 2008;10(1):103-109.
[9] Fridén M, Winiwarter S, Jerndal G, et al. Structure-brain exposure relationships in rat and human using a novel data set of unbound drug concentrations in brain interstitial and cerebrospinal fluids. J Med Chem. 2009;52(20):6233-6243.
[10] Gupta A, Chatelain P, Massingham R, Jonsson EN, Hammarlund-Udenaes M. Brain distribution of cetirizine enantiomers: comparison of three different tissue-to-plasma partition coefficients: K(p), K(p,u), and K(p,uu). Drug Metab Dispos. 2006;34(2):318-323.
[11] Cheng FC, Ho YF, Hung LC, Chen CF, Tsai TH. Determination and pharmacokinetic profile of omeprazole in rat blood, brain and bile by microdialysis and high-performance liquid chromatography. J Chromatogr A. 2002;949(1-2):35-42.
[12] Kerns, E. H. , and L. Di . Drug-Like Properties: Concepts, Structure Design and Methods. Elsevier LTD, Oxford, 2008.
[13] Stevens J, Suidgeest E, van der Graaf PH, Danhof M, de Lange EC. A new minimal-stress freely-moving rat model for preclinical studies on intranasal administration of CNS drugs. Pharm Res. 2009;26(8):1911-1917.
[14] Jadhav S B , Khaowroongrueng V , Derendorf H . Microdialysis of Large Molecules. J Pharm, 2016:3233-3242.
[15] Hou Y, Bai J, Zhang Y, Meng X, Zhang S, Wang X. Dynamic Continuous Blood Extraction from Rat Heart via Noninvasive Microdialysis Technique. J Vis Exp. 2022;(187):10.3791/64531. Published 2022 Sep 13.
[16] Holmgaard R, Benfeldt E, Bangsgaard N, et al. Probe depth matters in dermal microdialysis sampling of benzoic acid after topical application: an ex vivo study in human skin. Skin Pharmacol Physiol. 2012;25(1):9-16.
[17] Baumann K, Falkencrone S, Knudsen NP, Woetmann A, Dabelsteen S, Skov PS. The Skin Reservoir Model: A Tool for Evaluating Microdialysis Sampling of Large Biomarkers from Human Skin. Acta Derm Venereol. 2020;100(1):adv00008. Published 2020 Jan 7.
[18] Points to consider on pharmacokinetics and pharmacodynamics in the development of antibacterial medicinal products. (www.emea.eu.int/pdfs/human/ewp/265599en.pdf)
[19] Rea H, Kirby B. A Review of Cutaneous Microdialysis of Inflammatory Dermatoses. Acta Derm Venereol. 2019;99(11):945-952.
[20] Sun N, Xie Y, Sheng C, et al. In vivo pharmacokinetics and in vitro antifungal activity of iodiconazole, a new triazole, determined by microdialysis sampling. Int J Antimicrob Agents. 2013;41(3):229-235.
[21] Abdel-Rahman EM, Abadir PM, Siragy HM. Regulation of renal 12(S)-hydroxyeicosatetraenoic acid in diabetes by angiotensin AT1 and AT2 receptors. Am J Physiol Regul Integr Comp Physiol. 2008;295(5):R1473-R1478.
[22] Awad AS, Webb RL, Carey RM, Siragy HM. Increased renal production of angiotensin II and thromboxane B2 in conscious diabetic rats. Am J Hypertens. 2005;18(4 Pt 1):544-548.
[23] Alanazi, Wael & Fakhruddin, Selim & Jackson, Keith. Microdialysis Sampling of Renal Interstitial Fluid in Acute Studies. Int. J. Biol. Sci. 2013; 8(69): 1916-9671
[24] Pierce, Charles F et al. “Cerebral Microdialysis as a Tool for Assessing the Delivery of Chemotherapy in Brain Tumor Patients.” World neurosurgery vol. 145 (2021): 187-196.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息













