信使RNA(messenger RNA,mRNA),是由DNA的一条链作为模板转录而来的、携带遗传信息能指导蛋白质合成的一类单链核糖核酸。在真核生物中,完整的mRNA包括有5'端帽、5'非翻译区、编码区、3'非翻译区和poly(A)尾链。
mRNA作为一类新兴药物,因其优异的可编程性和安全性被广泛应用于传染病疫苗、肿瘤免疫疗法、基因治疗和蛋白质替代疗法等重要研究领域。
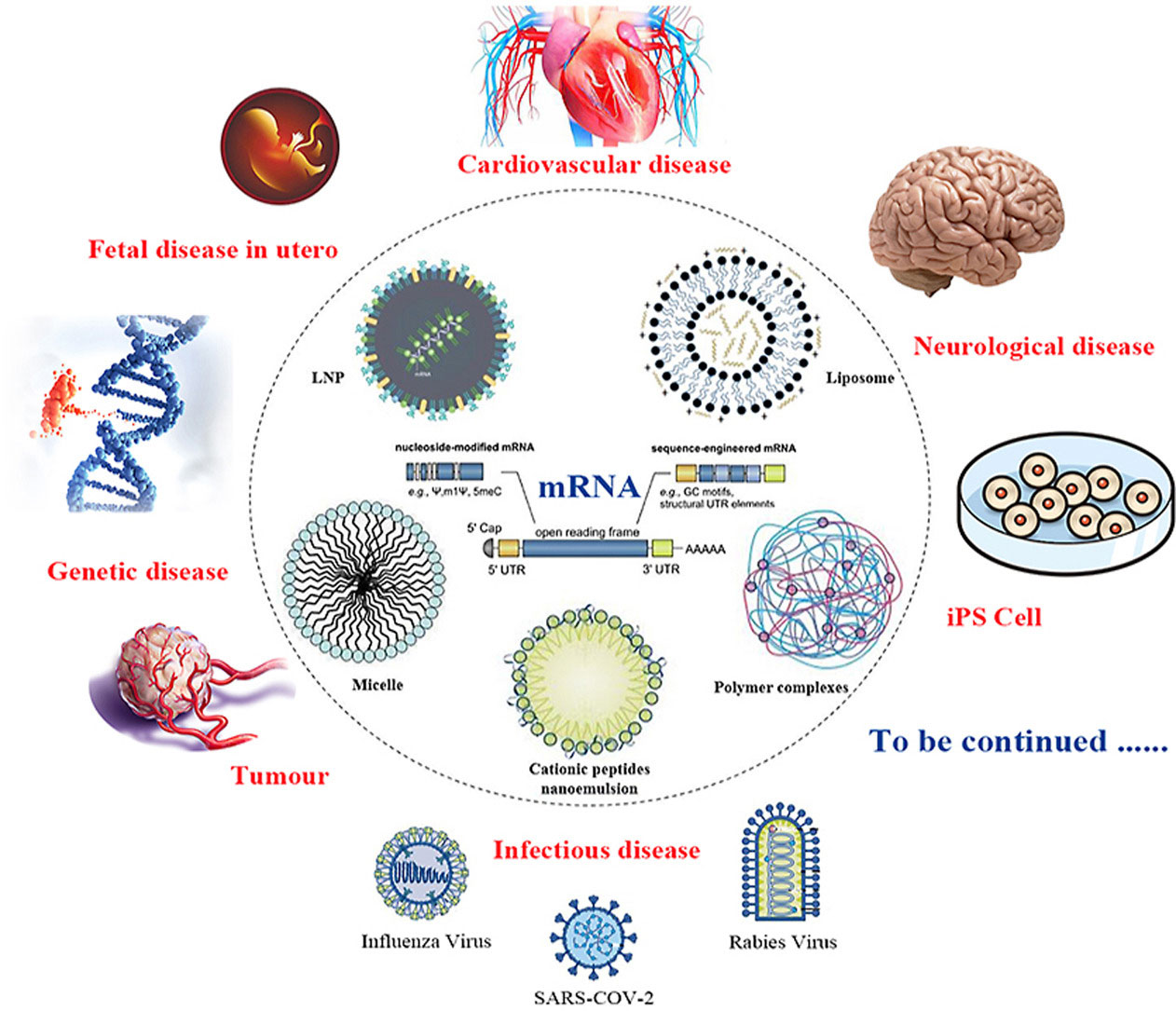
图1. mRNA靶向递送系统及其应用领域[1]
通过mRNA化学结构修饰可以提高部分药物在体内的稳定性、靶向性,提高递送效率,同时降低药物的免疫原性;应用mRNA类药物载体可以帮助药物到达病灶,有助于核酸类药物实现更高效的内体逃逸,促进药物在体内发挥作用。本文将通过介绍mRNA药物修饰、递送、治疗等方面的研究,阐述mRNA药物的修饰加帽率测定、递送系统测定以及mRNA药物定量分析等分析方法,助力mRNA药物研究。
mRNA药物修饰
mRNA药物在多种疾病的预防和治疗中展现了巨大的应用价值,其稳定性和翻译效率尤为重要,为了保证mRNA免受核酸酶的降解并靶向特定组织和细胞以满足临床转化的要求,需要对mRNA结构和核苷酸进行修饰。
mRNA的修饰主要包括:
5'非翻译区(5'UTR)Pseudouridine(Ψ)替代天然尿苷。
开放阅读框(Open Reading Frame)N1-Methylpseudouridine(m1Ψ)、 5-Methoxyuridine(mo5U)、2-Thiouridine(s2U)、5-Methylcytine(m5C)、5-Hydorxymethylcytidine(hm5C)分别替代天然尿苷和天然胞苷。
3'非翻译区(3'UTR)N6-Methyladenosine(m6A)、N1-Methyladenosine(m1A)替代天然腺苷。
5'帽端修饰,5'帽结构对mRNA转录起始以及mRNA稳定性都至关重要,越来越多帽结构类似物的发现将极大地促进mRNA药物的发展。
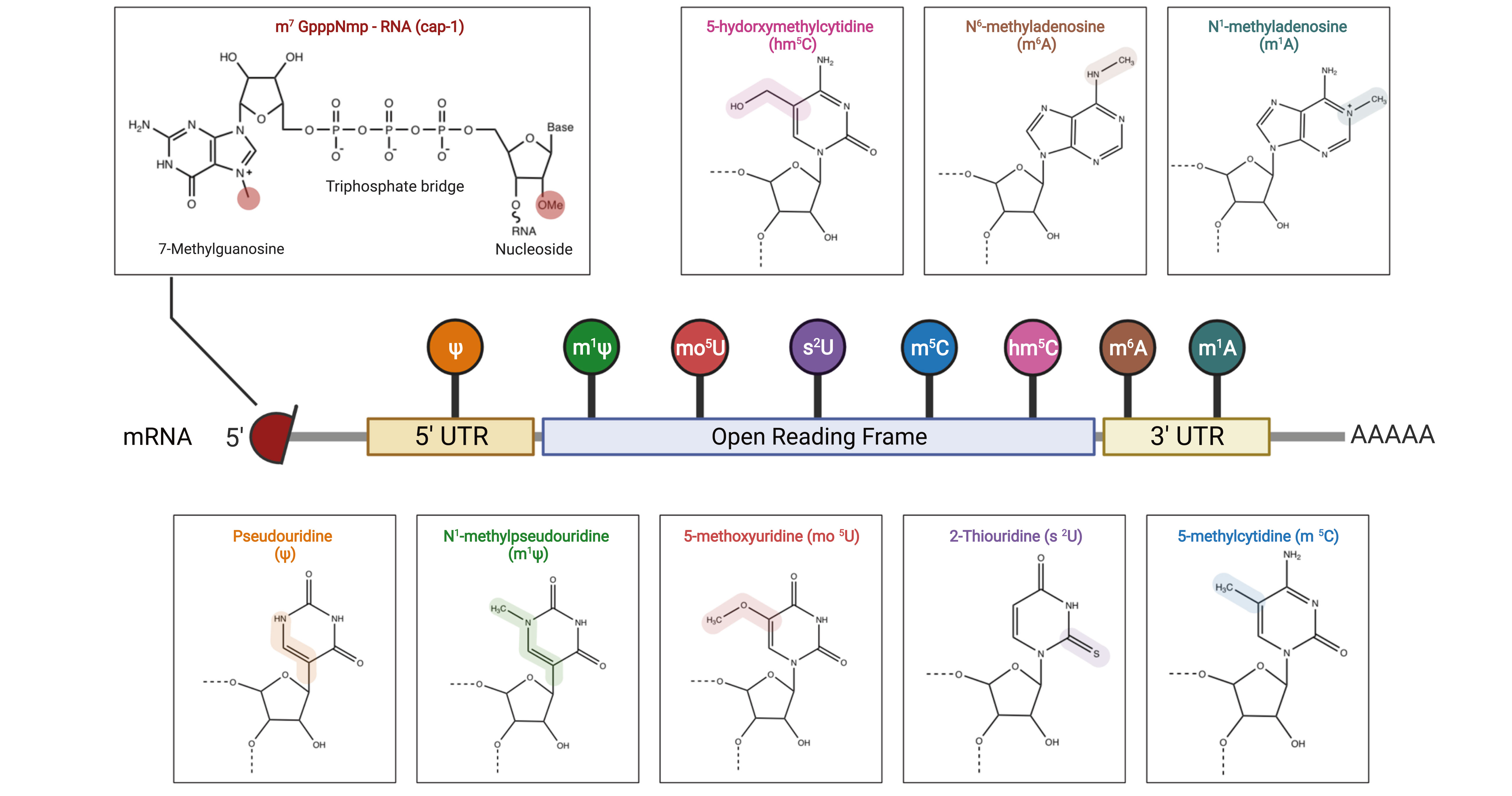
图2. mRNA结构和核苷酸修饰[2]
在mRNA药物修饰中5'帽位于不同甲基化程度的mRNA的5'端,5'端帽(m7G ppp)含有一个7-甲基鸟苷(m7G),通过 5'-5'三磷酸桥(ppp)连接核苷酸。mRNA结构优化的众多策略已被应用于优化m7G或三磷酸桥,以实现mRNA的稳定性和翻译效率。
mRNA通过修饰不仅降低了免疫原性,还实现了更高的稳定性和细胞内表达以及更有效的递送。
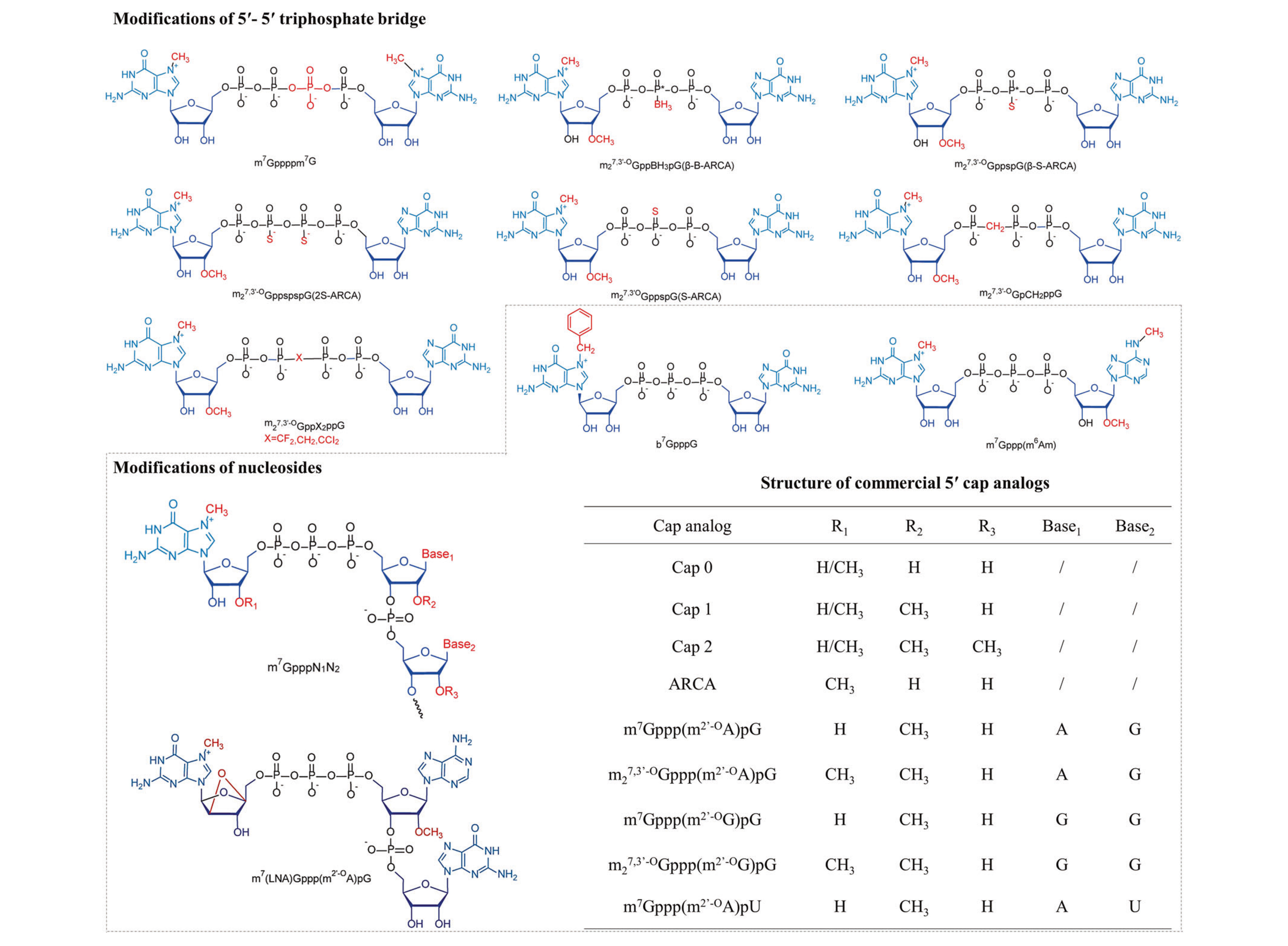
图3. 5'帽结构修饰[3]
mRNA药物递送
mRNA的修饰和递送系统相辅相成,会共同影响mRNA治疗的效率和效果。mRNA具有负电荷以及生物大分子的属性,不能直接作用于细胞或进行注射,因此需要安全高效的递送系统帮助mRNA免受核酸酶降解,并增加细胞摄取和内涵体逃逸。目前已经研发出多种mRNA递送系统,包括脂质纳米粒、聚合物纳米粒、无机纳米粒以及基于蛋白质的类病毒纳米粒等,其中脂质体纳米颗粒应用最为广泛。
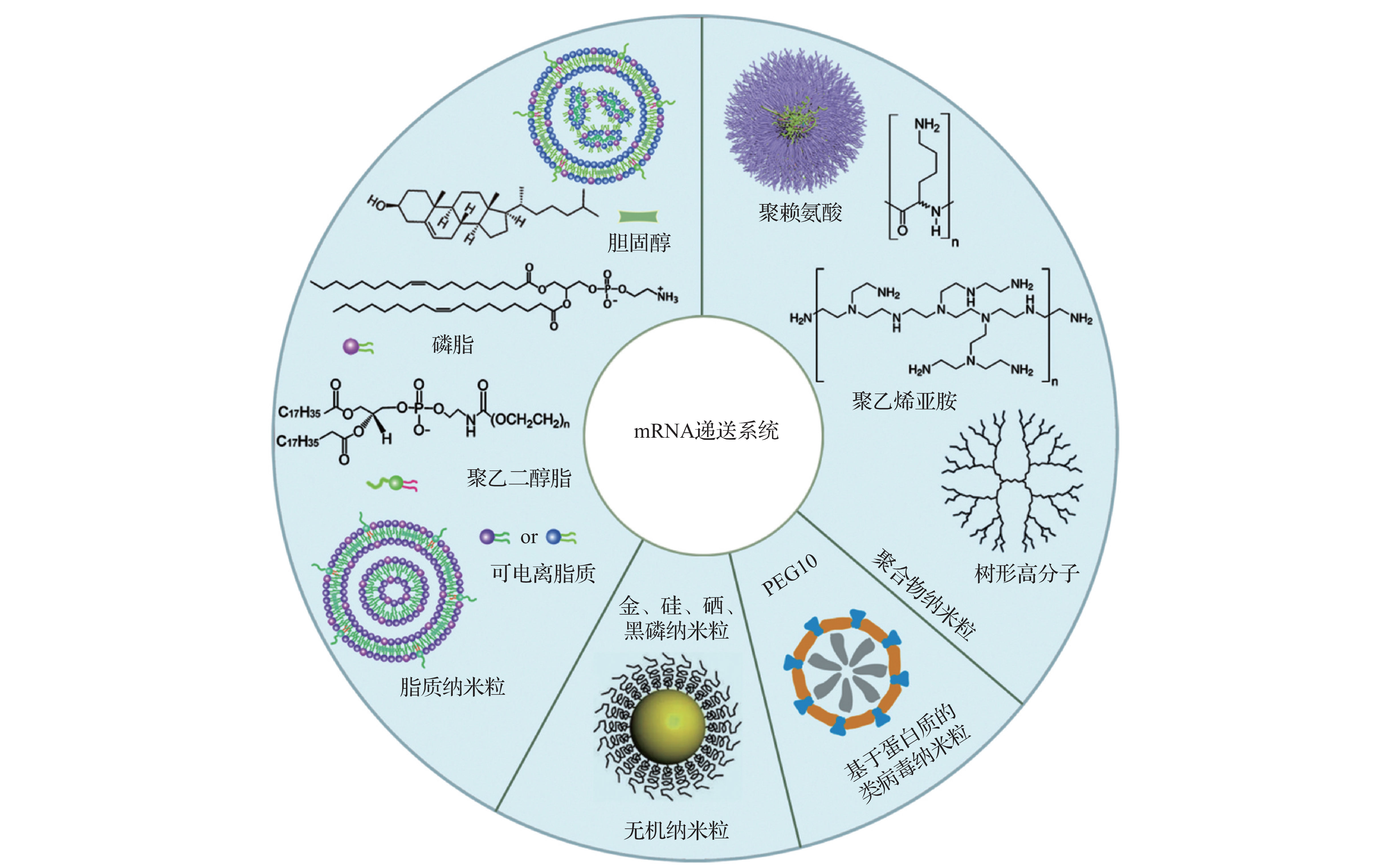
图4. 具有代表性的mRNA递送系统示意图[4]
在众多递送系统中,脂质纳米颗粒(LNP)是使用率最高、最受关注的递送系统,它通常包括:可电离阳离子脂质、聚乙二醇脂、辅助脂质、胆固醇。LNP中的每种物质都有不同的作用,其中:
可电离阳离子脂质可促进核酸在LNPs中的包裹和介导内体膜破裂,使核酸释放到胞质溶胶中。此外,可电离脂质在内体摄取中也起重要作用,通过可电离脂质上的正电荷与带负电荷的细胞膜之间的相互作用,以及与支持细胞摄取的血浆蛋白的结合[5]。
聚乙二醇脂是一种亲水性合成聚合物,通常用于通过偶联或修饰难溶性基序或载体转运分子的表面来帮助提高治疗药物或疫苗的溶解度和循环半衰期,减少网状内皮系统的清除、延长循环时间、改善药代动力学并提高药物疗效。
辅助脂质支持储存和循环过程中的稳定性。
胆固醇主要作用为介导LNP内吞,并有利于确保LNP的双层结构及脂质的流动性。
最新一代的可离子化脂质纳米粒颗粒,在低pH值的环境中携带正电荷,与mRNA形成复合体,提高mRNA稳定性,在生理pH值时为中性,这减少了它与血液中细胞的细胞膜之间的相互作用,降低脂质毒性。在被细胞摄入后,内体的酸性环境让它们重新携带正电荷,促进mRNA从内体的脱离。为降低mRNA药物剂量以及减少毒副作用,可通过在纳米粒表面修饰靶向分子,从而与组织或细胞的受体特异性识别和结合,增加mRNA对特定组织或细胞的有效递送。
mRNA药物治疗
通过优化mRNA的修饰和递送方法,可以显著提高mRNA治疗的疗效和安全性,使其有望成为多种难治性疾病的有力治疗手段,包括传染性疾病、代谢性遗传疾病、癌症、心脑血管疾病和其他疾病。
随着新冠大流行的消退以及mRNA疫苗在新冠中的巨大成功,mRNA疫苗在未来将会有更加广阔的应用,而mRNA疫苗的主要原理如下:
注射的mRNA疫苗被抗原呈递细胞内吞。
mRNA进入胞质后,由核糖体翻译成蛋白质,翻译的抗原蛋白可以通过几种方式刺激免疫系统。
细胞内抗原被蛋白酶体复合物分解成较小的片段,片段通过主要组织相容性复合体(MHC)Ⅰ类分子在细胞表面展示给细胞毒性T细胞(CD8+T细胞)。
活化的细胞毒性T细胞通过分泌溶细胞分子,如穿孔素、颗粒酶等杀死感染细胞。
此外,分泌的抗原可被细胞摄取,在内体内部降解,并通过MHC II类蛋白在细胞表面呈递给辅助性T细胞(CD4+T细胞)。
辅助性T细胞通过刺激B细胞产生抗体,并通过炎性细胞因子激活吞噬细胞,如巨噬细胞,有利于循环病原体的清除。
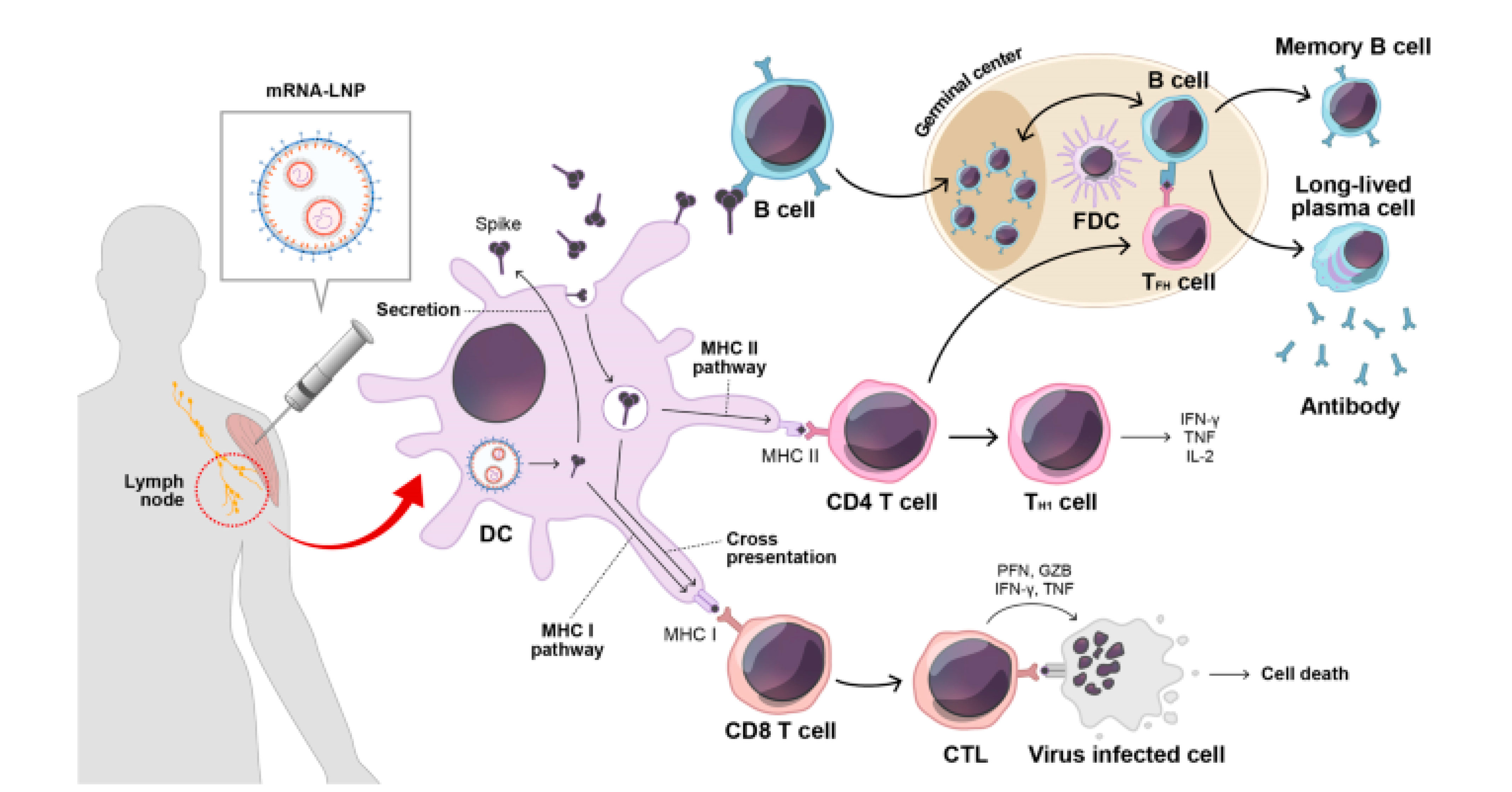
图5. mRNA疫苗诱发细胞和抗体介导免疫的作用机制[6]
mRNA在疫苗方面的成功也推动了其他疗法的发展,主要包括:
癌症治疗,包括预防性癌症疫苗和治疗性癌症疫苗。
基因编辑疗法及CRISPR/Cas核酸酶系统。
其他如罕见病、心血管以及自身免疫性疾病等领域。
尽管mRNA药物前景广阔,但是仍面临一些挑战,如mRNA的稳定性、递送系统的效率和安全性等。因此mRNA的设计、递送以及药物本身的定量分析研究尤为重要。
mRNA药物生物分析
mRNA属于新型药物,只有开展系统的评估,才能保证mRNA修饰和递送在治疗中的有效性和安全性,从而优化设计并提高治疗的成功率。下文将从三个方面介绍mRNA药物分析策略:
LC-MS/MS定量分析mRNA药物递送系统中的脂质体;
LC-HRAM评估修饰后的mRNA药物加帽率;
RT-qPCR定量分析修饰后的mRNA药物。
LC-MS/MS定量分析mRNA药物递送系统中的脂质体
由于在mRNA递送系统中脂质体纳米颗粒(LNP)是应用最为广泛的递送系统。而脂质体纳米颗粒中,可离子化阳离子脂质占50%,剩下10%是中性脂质,38%-40%是胆固醇。脂质纳米颗粒模拟细胞膜形成细胞,直径只有100纳米左右,成分包括中性脂质、阳离子脂质、胆固醇、PEG-脂质。其中阳离子脂质与带负电的 mRNA 结合,可高效包载核酸药物,同时提供正电荷,与带负电荷的mRNA复合,有助于内涵体逃逸,mRNA体内转染,可离子化脂质具有pH敏感性。对于阳离子脂质的分析依赖于LC-MS/MS分析,但是由于阳离子脂质本身的特异性,在LC-MS/MS分析中往往存在以下问题:
阳离子脂质极性较小,在色谱上难以洗脱。
峰型拖尾、残留大。
优化峰型后对灵敏度有影响。
针对阳离子脂质的问题我们通过如下办法优化:
选择合适的色谱柱,确保干扰、化合物在色相色谱上分离。
优化流动相组成、调节添加剂浓度、强酸和甲酸的比例,优化峰型、化合物信号和残留。
调整洗脱溶剂的组成和比例,降低化合物残留。
最终开发出一套针对阳离子脂质的分析方法,方法中阳离子脂质的LLOQ能达到0.1ng/mL,残留小于1‰,线性范围达到3000倍,能够满足多种基质类型的分析。
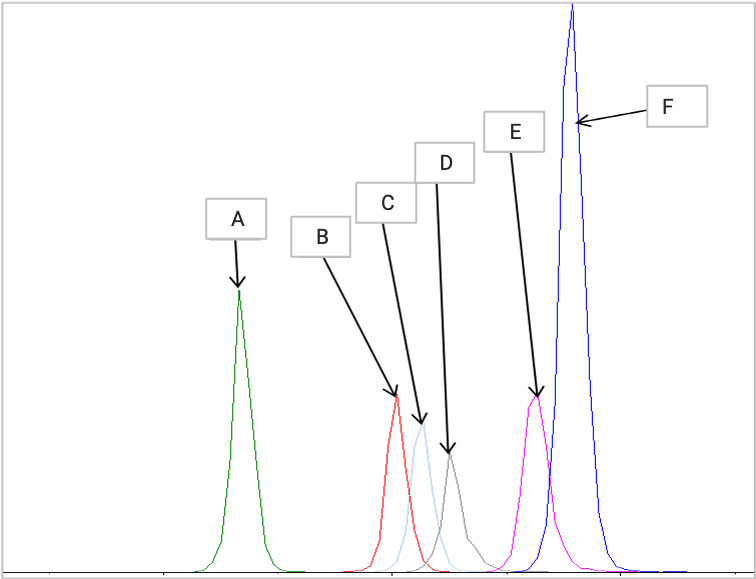
图6. 多种阳离子脂质同时分析
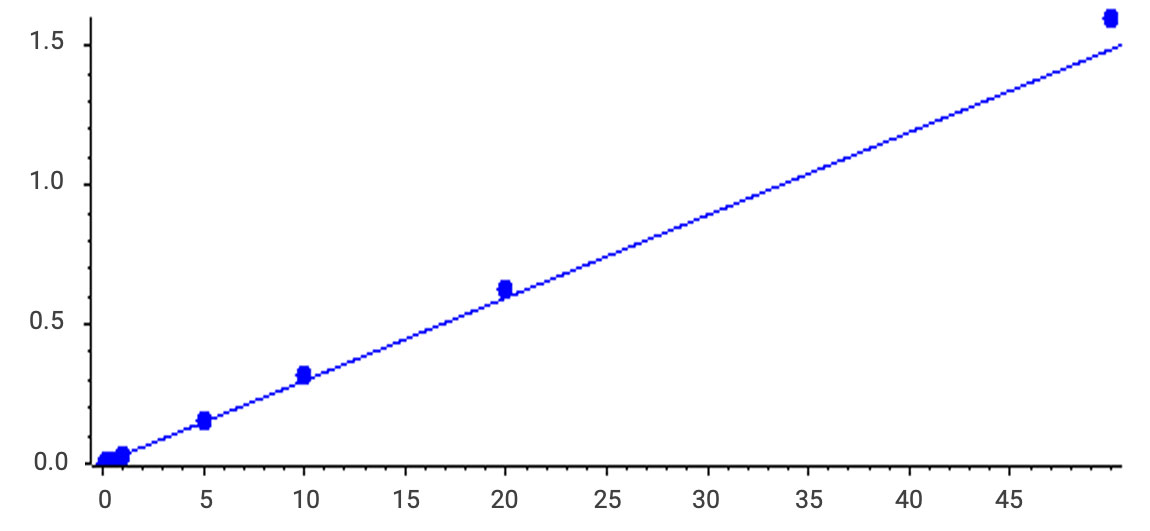
图7. 阳离子脂质线性(0.1-50ng/mL,r=0.99498)
LC-HRAM评估修饰后的mRNA药物加帽率
在mRNA修饰中,加帽率是一个重要的指标。mRNA的5'加帽结构对其翻译水平至关重要,(ARCA,3-O-Me-m7G(5')PPP(5')G)已被广泛用于确保在从DNA模板转录期间5'末端的cap以正确的方向掺入。然而,由于三磷酸鸟苷(GTP)和ARCA之间的竞争,以这种方式产生的mRNA不是100%加帽的。液相色谱与高分辨率质谱联用(LC-HRAM)可用于从其5'分子中区分和定量未加帽和加帽的mRNAs。在药明康德DMPK内部验证项目中,建立了LC-HRAM评估36个核苷酸(nt)mRNA的加帽效率的方法,其提供了所需的分辨率和准确度。
该方法通过使用HiScribe T7 ARCA mRNA试剂盒(NEB, MA)从线性化质粒共转录,并使用TURBO DNase(Thermo Fisher,NY)和Monarch RNA Cleanup Kit(NEB,MA)进一步纯化,产生长度为36nt的ARCA加帽mRNA。将其保存于-80℃下,用于以后的LC-HRAM分析。
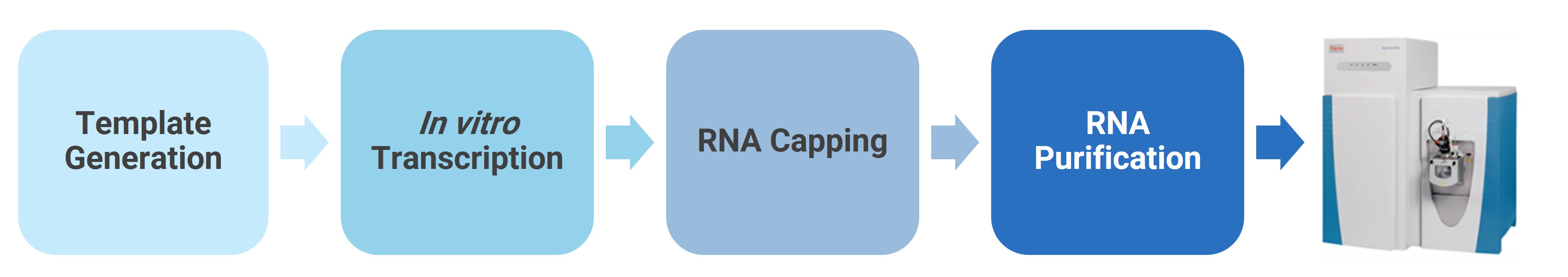
图8. mRNA样品制备及分析方案
随着离子对反相(IP-RP)LC-MS方法在分离和分析寡核苷酸及相关含磷分析物方面的研究和发展,利用二异丙基乙胺(DIPEA)作为IP试剂,并用1,1,1,3,3,3-六氟-2-丙醇(HFIP)进行缓冲,以提高DIPEA的离子对效率。为了评估高分辨率质谱分析加帽mRNA和潜在转录副产物的实用性,使用ACQUITY UPLC寡核苷酸BEH C18色谱柱或ACQUITY UPLC BEH C4蛋白色谱柱测试了不同的液相色谱条件。使用寡核苷酸BEH C18柱,可以通过更长的梯度实现加帽mRNA和较小RNA种类的更好分离,但是使用BEH C4柱的5分钟方法也获得了加帽mRNA的良好表征,且没有牺牲较低丰度种类的分辨率。
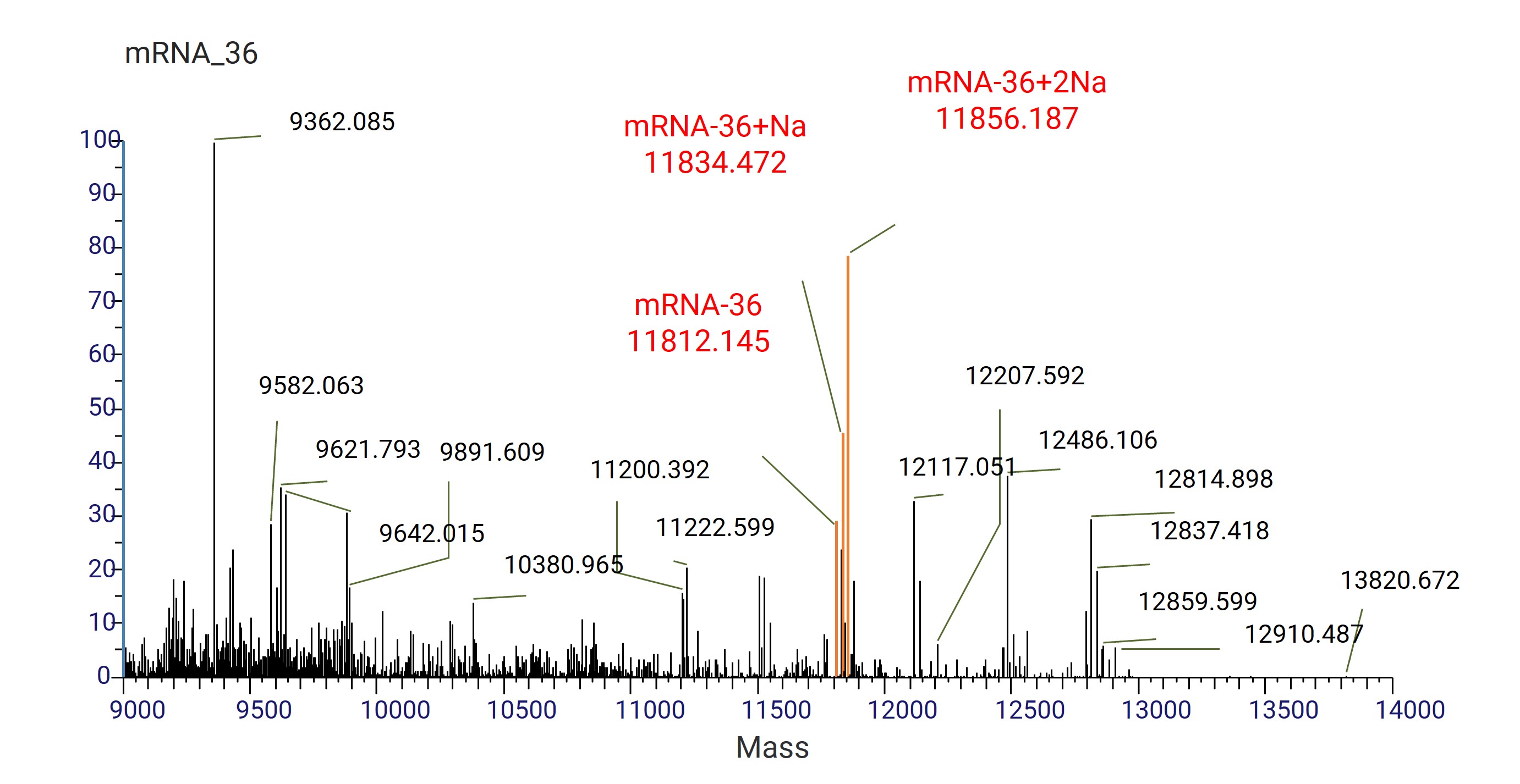
图9. mRNA-36反卷积质谱
36nt的共转录ARCA加帽的mRNA片段,起始于5'末端的分子3-O-Me-m7G(5')PPP(5')G,与起始于5'末端的未加帽的分子PPP(5')G,通过它们再进行LC-HRAM时的质量和保留时间的差异来区分。mRNA的加帽效率可以通过定量加帽和未加帽的mRNA来计算。因此离子对反相色谱法可用于分离未加帽和加帽的mRNA片段。
RT-qPCR定量分析修饰后的mRNA药物
目前mRNA分析的方法有实时荧光定量逆转录聚合酶链式反应、细胞成像技术、微阵列技术、液质联用技术、毛细管凝胶电泳等方法。由于逆转录聚合酶链式反应具有高灵敏度、高特异性、高度选择性和容易操作等优点,PCR技术成为核酸扩增技术的金标准,并已被广泛应用于基础研究、医学诊断、法医学和环境检测等领域。在过去的数年中,RT-qPCR已成为DNA或RNA检测和定量的主要工具,主要因为其具备以下优点:
能够实时监控PCR反应的进程。
能够精确测定每个循环的扩增片段数量,从而对样本中的起始材料量进行准确定量。
具有更大的检测动态范围。
在单管中实现扩增和检测,无需PCR后处理。
RT-qPCR方法开发流程
RT-qPCR方法开发流程主要包括样品裂解和mRNA提取、引物设计、逆转录、RT-qPCR和数据定量分析。
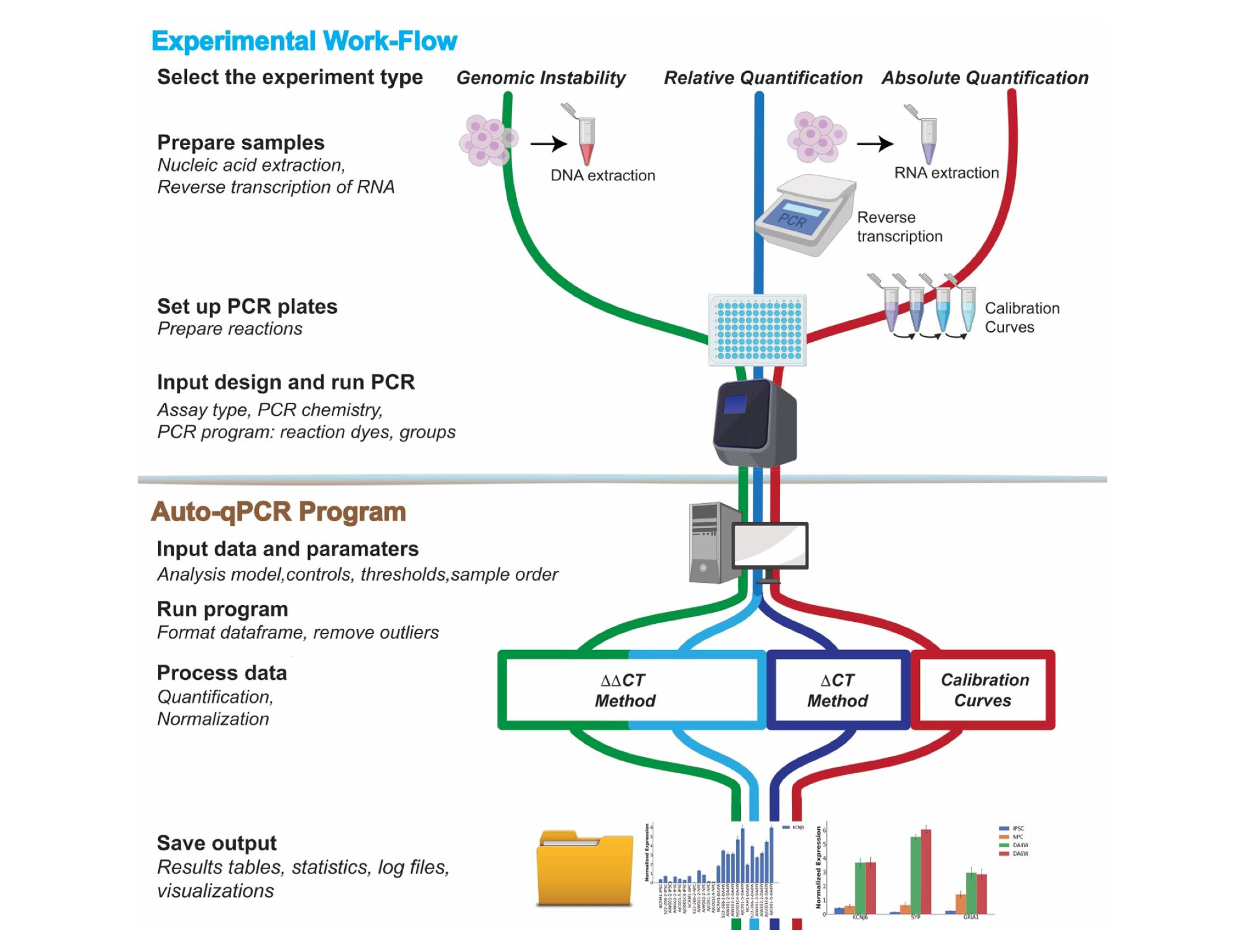
图10. RT-qPCR流程[7]
在RT-qPCR中,一步法和两步法是两种最常用的RT-PCR方法。一步法可在同一管内完成第一链cDNA合成反应和实时荧光定量PCR反应。两步法包含两个独立反应,先进行第一链cDNA合成,然后再通过PCR扩增第一步骤中所得cDNA。
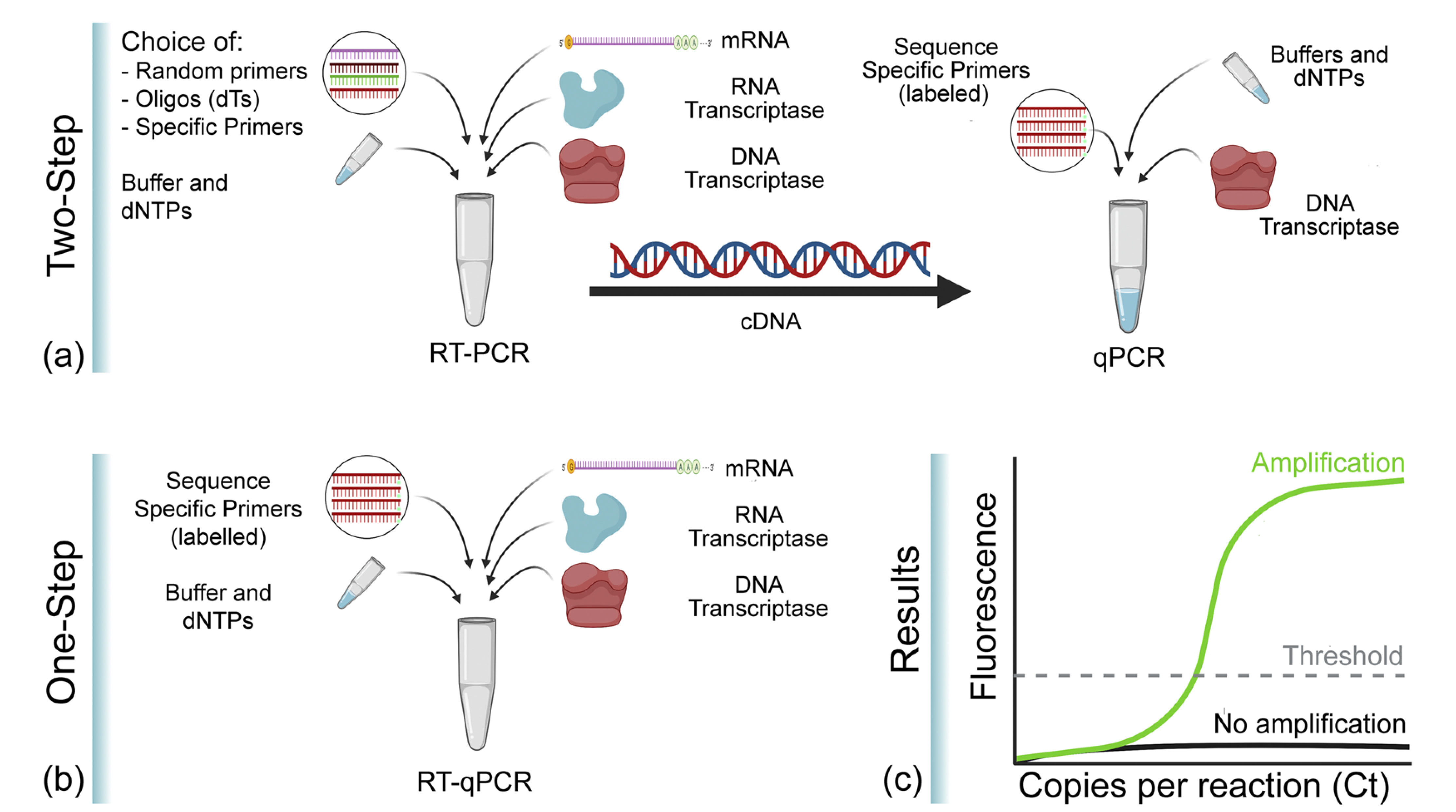
图11. RT-qPCR一步法和两步法操作步骤对比[8]
药明康德DMPK开发了具有超高检测灵敏度的RT-qPCR方法,对小鼠血浆、肺、脑、肿瘤等多种基质进行定量分析,并对方法的特异性、选择性、灵敏度、线性范围、准确度和精密度进行了方法学验证。该方法采用试剂盒提取mRNA,随后通过基于TaqMan探针的一步法的qPCR反应检测体系,具有良好准确度和精密度。
本方法展现出了出色的灵敏度和较宽的动态范围,LLOQ低至0.001 ng/mL,线性范围在0.001-500 ng/mL之间,扩增效率在90%-110%之间。
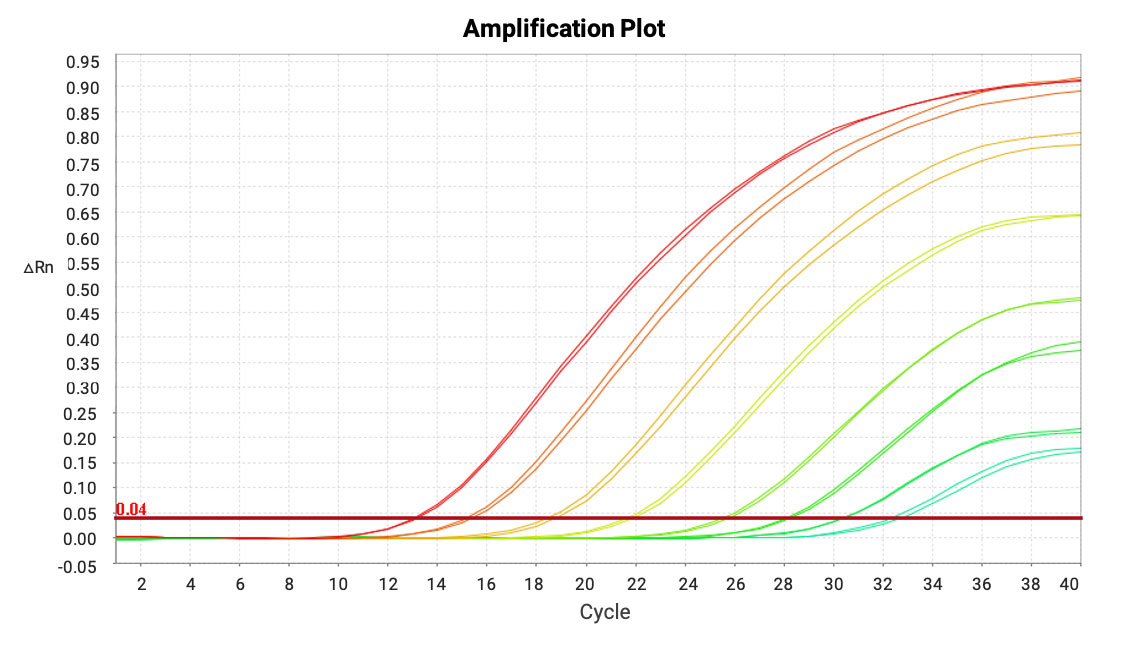
图12. mRNA在小鼠肺匀浆液样品中的扩增曲线
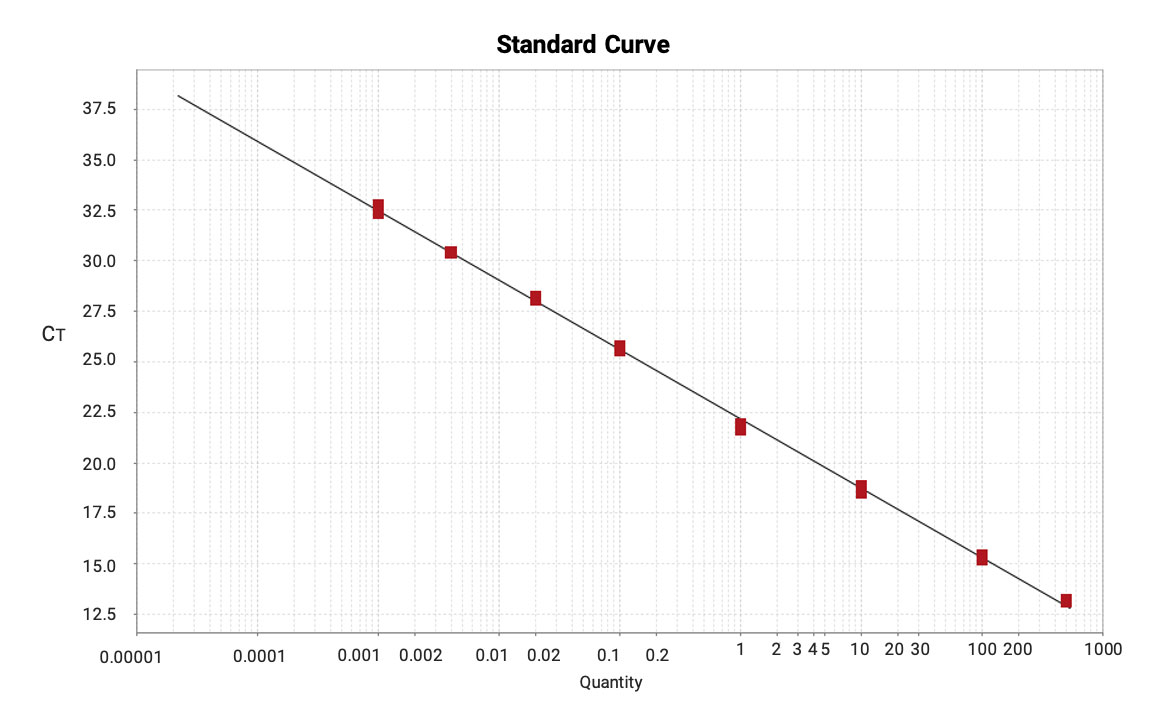
图13. mRNA在小鼠肺匀浆液样品中的校准曲线(0.001-500 ng/mL,R2=0.999)
mRNA药物修饰和递送研究提高了mRNA的稳定性和递送效率,使其具有更广阔的应用前景。定量分析也为mRNA药物研究提供更准确的加帽率、药物效力、精准的给药剂量以及临床研究和疗效评估等数据支持。
结 语
药明康德DMPK不仅建立了针对mRNA药物递送系统的常规LC-MS/MS分析方法,能够快速完成递送系统化合物的分析并解决遇到的问题;还建立了一套完整的测定5'帽加帽率的高分辨色谱分析方法,能够系统评估mRNA药物的加帽率;另外针对mRNA药物的分析,建立了高通量、智能化分析平台,包含QIAcube HT 高通量核酸提取仪、KingFisher全自动核酸提取仪、QIAgility自动化PCR体系构建、QuantStudio™ 7 Flex,能够快速完成大批量的样品分析,缩短项目分析周期。同时,药明康德DMPK配备专业的核酸分析人员,能够从专业的角度完成客户的问题、引物设计、项目方法开发等,旨在最大程度满足客户的项目分析需求,加速新药研发。
图14. 高通量、自动化核酸提取设备
作者:龚武云,张显春,黄小清,蒋嘉明,李陟昱,邢丽丽
编辑:富罗娜·克里木,钱卉娟
设计:倪德伟,张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系。
参考
[1] Mingyuan Li,Yuan Li,Shiqin Li,Lin Jia,Haomeng Wang,Meng Li,Jie Deng,Ali Zhu,Liqiao Ma,Weihong Li,Peng Yu,Tao Zhu.The nano delivery systems and applications of mRNA. Eur J Med Chem. 2021 Oct 8;227:113910.
[2] Enyue Fang,Xiaohui Liu,Miao Li,Zelun Zhang,Lifang Song,Baiyu Zhu,Xiaohong Wu,Jingjing Liu,Danhua Zhao and Yuhua Li.Advances in COVID-19 mRNA vaccine development.Signal Transduction and Targeted Therapy volume 7,Article number: 94 (2022).
[3] Shugang Qin,Xiaoshan Tang,Yuting Chen,Kepan Chen,Na Fan,Wen Xiao,Qian Zheng, Guohong Li,Yuqing Teng,Min Wu,Xiangrong Song.mRNA-based therapeutics: powerful and versatile tools to combat diseases.Signal Transduct Target Ther. 2022 May 21;7:166.
[4] 周正杰,李鑫.信使RNA药物修饰及其递送系统研究进展,浙江大学学报.2023 Aug 25; 52(4):439–450.
[5] Camilla Hald Albertsen,Jayesh A Kulkarni,Dominik Witzigmann,Marianne Lind,Karsten Petersson,Jens B Simonsen.The role of lipid components in lipid nanoparticles for vaccines and gene therapy. Adv Drug Deliv Rev. 2022 Jul 3;188:114416.
[6] Nargish Parvin, Nargish Parvin, Tapas Kumar Mandal.Enhancing Vaccine Efficacy and Stability: A Review of the Utilization of Nanoparticles in mRNA Vaccines. Biomolecules 2024, 14(8), 1036.
[7] Gilles Maussion, RhalenaA.Thomas,Iveta Demirova,Gracia Gu,Eddie Cai,Carol X.‑Q.Chen,NargesAbdian,Theodore J. P. Strauss,Sabah Kelaï,Angela Nauleau‑Javaudin, Lenore K. Beitel,Nicolas Ramoz,Philip Gorwood&Thomas M. Durcan.Auto-qPCR; a python-based web app for automated and reproducible analysis of qPCR data. Scientific Reports volume 11, Article number: 21293 (2021) Cite this article.
[8] Maria Soler,Alexis Scholtz,Rene Zeto,Andrea M. Armani.Engineering photonics solutions for COVID-19.APL Photonics 5, 090901 (2020).
加入订阅
获取药物代谢与药代动力学最新专业内容和信息



















