神经系统是机体对生理功能活动的调节起主导作用的系统,分为中枢神经系统(Central Nervous System, CNS)和周围神经系统两大部分。其中,CNS是神经系统的主要部分,包括脑和脊髓两部分。当中枢神经系统出现疾病的时候(表1,约翰霍普金斯研究所对中枢神经系统疾病的分类[1]),个体的生理功能或认知功能就会出现紊乱。
表1. 中枢神经系统疾病的分类[1]
疾病类型 | 疾病举例 |
脑血管疾病 | 中风、脑缺血等 |
感染性疾病 | 病毒性脑炎、隐球菌性脑膜炎等 |
结构性疾病 | 脑或脊髓损伤等 |
功能性障碍 | 头痛、癫痫、抑郁等 |
退行性疾病 | 帕金森、AD、亨廷顿病、肌萎缩侧索硬化症 |
世界卫生组织(World Health Organization,WHO)2022年6月发布的报告显示,世界上大约有1/8的人患有精神障碍[2]。痴呆症患者的数量逐年递增(图1)。以中老年患者为主的痴呆(阿尔茨海默症占60%-70%)是全世界第五大死因[3]。然而由于各种原因,如中枢神经系统不具有再生能力、疾病机制复杂、临床前动物模型可靠性低、临床研究困难、常规药物难以穿越血脑屏障(Blood Brain Barrier, BBB)到达靶部位、药物安全性要求高、患者依从性差等,CNS药物的研发成功率非常低 (~8%),在阿尔兹海默症疾病上的失败率更是超过99%[4]。但是,尽管经历了各大药厂的“撤军”,CNS领域的热度仍居高不下。以全球在研管线数量计算,神经学药物(包括CNS系统疾病治疗和心理健康治疗)已成为仅次于肿瘤的第二大治疗领域[5]。总体来讲,CNS药物的研发既充满挑战也充满机遇,呈现出高风险高收益的特点。
通过结构设计和改造,提高化合物跨越血脑屏障BBB的能力是提升CNS药物开发成功率的关键因素之一。本文将主要从药物跨越血脑屏障的途径出发,介绍如何提高小分子跨越血脑屏障的能力,同时从DMPK角度介绍脑通透的相关参数和评价方法,为CNS药物的开发提供参考。

图1. 不同收入国家痴呆症患者数量的增长趋势[6]
一、脑屏障
大脑是我们身体里“戒备最森严”的器官。除了有7 mm的颅骨来抵抗外界的机械损伤以外,还有一个特殊的脑屏障来保护大脑免受体循环中有害物质的侵袭。脑屏障包括血‑脑屏障(BBB)、血-脑脊液屏障(blood-CSF barrier, BCSFB)和脑脊液-脑屏障(CSF-brain barrier)(图2)。这三种屏障中,脑脊液-脑屏障的通透性最好,其次是BCSFB,通透性最差的就是BBB。

图2. 脑屏障的三房室模型,示意游离化合物在血浆、脑组织和CSF的动态平衡分布[3]
BBB: blood brain barrier;
BCSFB: blood cerebrospinal fluid barrier;
Cp,u: plasma unbound drug concentration;
Cb,u: brain unbound drug concentration;
CCSF: CSF drug concentration;
血-脑屏障(BBB)的通透性差是由其结构决定的。BBB中的毛细血管属于连续毛细血管(continuous capillary), 血管内皮细胞相互连接,细胞间有紧密连接(tight junction),基膜连续且完整。常规毛细血管的内皮细胞有孔,细胞间空隙较大,且基膜不完整。除此之外,BBB的毛细血管外还有星形胶质细胞终足围绕(图3)。体循环中的药物需要穿透这些基础结构形成的血脑屏障才能入脑。

图3. BBB与普通毛细血管的对比[6]
二、化合物渗透BBB的方法
虽然BBB结构紧密、渗透性低,但也无时不刻不在跟血液、CSF等进行物质交换。物质进出BBB主要有下图展示的6种方式。绝大多数的亲脂小分子是通过被动扩散进入。少数极性的小分子可以通过细胞旁路进入。内源性小分子或者类似物可以通过脑内皮细胞表达的转运蛋白介导的摄取进入,这也是生物药常用的递送方式。经各种方式入脑的物质也可能被外排转运体排出。
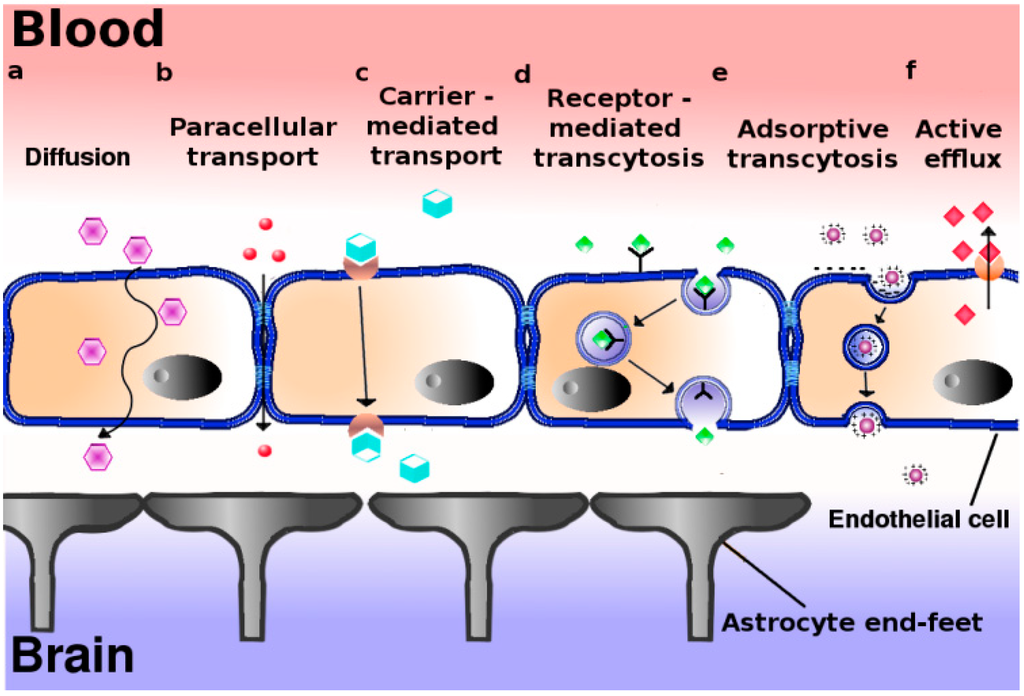
图4. 物质进出血脑屏障的方式[7]
(a) 被动扩散:疏水性小分子;(b) 细胞旁转运途径:水溶性小分子(较弱);(c) 载体介导的转运:内源性小分子/类似物;(d) 受体介导的转胞吞作用;(e) 吸附介导的转胞吞作用:阳离子化合物,非特异性;(f) 质子泵外排转运体.
如何提高小分子药物的血脑屏障通透性
药物化学领域的科学家们利用上述这些跨BBB的方式,设计或改造化合物的结构,增加其跨越BBB的能力。目前常用的策略有(图5):
改善药物物理化学性质:分子量、氢键受体、氢键供体、荷电性质、脂溶性。
改造药物结构:转运体/受体/载体-介导的入胞。
借助递送系统:脂质纳米粒、病毒载体、细胞载体。
短暂破坏紧密连接:物理超声/高渗试剂(甘露醇、阿拉伯糖、尿素等)。这种方法对于入脑的物质没有选择性,往往会引起神经毒性或者大脑机能受损。因此该方法的使用需格外谨慎。

图5. 跨越血脑屏障的方法[8]
对于小分子来说,改善药物物理化学性质是增加脑暴露水平的最有效手段。如下几条是行业认为行之有效的药物设计和改造的规则[9]。

图6. CNS药物设计和改造的规则
通过设计或改造得到的小分子化合物,需要借助一系列的体外实验,逐步筛选出具有良好的BBB渗透性、非外排转运体的底物、代谢稳定性良好的化合物。然后通过体内实验,评价化合物在血浆和脑内的游离化合物的浓度和暴露量。下面将具体阐述小分子化合物体外渗透性和转运体的评价体系,以及体内评价方法。
三、小分子脑渗透性评价体系
01 体外渗透性和转运体评价体系
化合物的脑渗透性是被动扩散、受体介导的外排和摄取三部分作用的综合结果。CNS药物要尽量提高脑部的被动扩散能力,同时避免是外排转运体的底物。BBB上的外排转运体主要是ABC(ATP-binding cassette)家族,主要包括P-gp(P-glycoprotein)和BCRP(Breast Cancer Resistance Protein)等。P-gp具有广泛的底物谱,是BBB上发挥外排作用的“主力军”。与P-gp相比,BCRP的底物类型较少,而且跟P-gp有一定的重合[10]。因此,在前期筛选阶段,可优先进行P-gp底物的评估。接下来主要介绍体外脑被动扩散评价体系BBB‑PAMPA和外排转运体评价体系MDR1-MDCK I细胞模型,以及药明康德DMPK推荐的筛选策略。
平行人工膜渗透模型(Parallel Artificial Membrane Permeability Assay, PAMPA)是用于检测化合物被动扩散透膜能力的常用模型。该模型是将卵磷脂有机溶液涂布在聚偏二氟乙烯膜(PVDF)上,卵磷脂在膜孔隙中形成稳定的薄膜,模拟细胞膜的脂质双分子层。BBB-PAMPA是将PAMPA体系中的卵磷脂换成猪的脑脂质提取物,更加贴近脑的细胞膜组分(图7)。因为没有转运体的影响,该体系可以单纯评价化合物的被动跨膜能力。实验表明,BBB-PAMPA与大鼠原位脑灌注具有很好的数据相关性[11](图8),是一种快速和低成本的预测化合物对BBB通透性的方法。

图7. BBB-PAMPA模型示意图

图8. BBB-PAMPA与大鼠原位脑灌注数据的相关性[12]
MDR1-MDCK I细胞来源于美国国立卫生研究院(National Institutes of Health,NIH),其P-gp的表达量比渗透性实验中常用的MDR1-MDCK II细胞高,同一化合物在MDR1-MDCK I细胞中得到的外排比(Efflux ratio, ER)也更高。实验表明,MDR1-MDCK I体系得到的ER值与大鼠和非人灵长类(NHP)的体内数据Kp,uu(见下文)具有较高的相关性(图9&图10)。而且,对于在MDR1-MDCK II中ER<3的化合物,MDR1-MDCK I表现出更宽的ER范围,对于化合物的区分度更高,更适合用来评价和预测化合物的入脑性质[12](图11)。

图9. 化合物在Current MDR1(MDR1-MDCK II)和NIH MDR1(MDR1-MDCK I)细胞体系中的外排比(ER)与大鼠脑Kp,uu的相关性[15]
以ER=3和Kp,uu=0.5作为cutoff值,NIH MDR1-MDCK I ER<3但Kp,uu<0.5的化合物个数更少,即以NIH MDR1-MDCK I的ER值评估化合物入脑的准确率更高。

图10. 化合物在MDR1-MDCK I细胞体系中的外排比(ER)与非人灵长类脑Kp,uu的相关性[15]
以ER=3和Kp,uu=0.5作为cutoff值,NIH MDR1-MDCK I ER值可以准确预测化合物的入脑性质。

图11. 化合物在MDR1-MDCK II和MDR1-MDCK I细胞体系中的外排比(ER)的对比[15]
在MDR1-MDCK II中ER<3的化合物,在MDR1-MDCK I中ER值在0-30。
为了验证BBB-PAMPA和MDR1-MDCK I预测化合物入脑情况的准确性,我们选取了24个商品化的化合物,包括10个能入脑(CNS+)的化合物和14个不入脑(CNS-)的化合物[13-17],分别在两个实验体系中进行了测试。我们分别以Pe=1.5*10‑6cm/s(Log Pe=‑5.85)(BBB‑PAMPA)和外排比ER=4(MDR1-MDCK I)为cutoff值,判断两个实验体系对化合物入脑预测的准确性。结果显示,若仅以MDR1-MDCK I或者 BBB‑PAMPA的数据判断化合物能否入脑,准确率均为83.3%(20/24,图12&图13)。如果先用MDR1-MDCK I的数据排除外排转运体的底物,再用BBB-PAMPA的数据排除渗透性较差的化合物,则能非常准确地把10个CNS+的化合物筛选出来(图14)。因此,对于早期筛选项目,我们建议使用MDR1‑MDCK I和BBB‑PAMPA相结合的方式进行入脑化合物的筛选。

图12. BBB-PAMPA预测化合物是否入脑的准确性(WuXi AppTec DMPK内部数据)

图13. MDR1-MDCK I判断化合物是否入脑的准确性(WuXi AppTec DMPK内部数据)

图14. BBB-PAMAPA与MDR1-MDCK I结合判断化合物是否入脑的准确性(WuXi AppTec DMPK内部数据)
除了避免是外排转运体的底物以外,化合物还可以设计成摄取转运体的底物。BBB中的摄取转运体种类多,很多已经被应用到化合物的设计中,例如LAT1、OATP1A2、OATP2B1、GLUT1、MCT1、CAT1和CNT2等。
02 体内脑渗透评价模型
原位脑灌注技术是研究化合物BBB 通透性的灵敏、定量和可控的一种方法。其使用含有已知浓度待测物的灌流液代替体循环血液,通过颈动脉进入大脑(图15)。灌注结束后,用不含药物的灌注液冲洗脑血管,取出脑并测定药物浓度。原位脑灌注方法所得的数据更接近药物真实的渗透情况。
原位脑灌注方法的优势有:
能得到准确直观的脑浓度;
可以扣除掉脑血管的药物影响;
时间短,将非特异性吸附(Non‑specific binding, NSB)降到最低;
同时给予转运体抑制剂或者运用转运体敲除的动物,还可以研究外排。
但该方法的局限性在于实验操作复杂、动物用量大、对分析检测要求高,且不能直接获得游离的Cmax和AUC。

图15. 原位脑灌注
脑微透析技术可以直接获得脑内游离药物浓度。它的原理是将包含前置透析膜的微透析探针植入脑组织中(图16),用人工细胞外液进行持续灌注。由于半透膜两侧存在浓度梯度,脑组织中的物质会被交换提取出。该技术可以在清醒动物脑内进行在体的微创连续采样,实时监测脑内游离药物浓度的变化情况。
Cb,u和AUCb,u(unbound brain AUC)是评价药物在脑部能否发挥药理活性的重要参数。通过动物脑部微透析的方法可以直接获得这两个参数。此外,如果在同一只动物上同时进行脑部和血液的连续透析,还可以直接得到Kp,uu(见下方公式)。
但不是所有化合物都适用于微透析系统。微透析膜对药物存在吸附作用,对于吸附性强,稳定性差的化合物,需要提前做一些体外预实验来确认微透析系统的可行性。

图16. 动物脑部微透析操作图
NeuroPK是较为广泛采用的方法。动物给药以后,在不同的时间点,分别采集血浆、CSF和脑组织,通过分析样品中的化合物浓度,获得总浓度和总暴露量(Cp,t、Cb,t 、CCSF、 AUCp,t、AUCb,t和AUCCSF)。结合体外的蛋白结合实验,即可获得游离化合物浓度和游离AUC。
动物的给药途径除了常规的静脉注射(IV)、口服(PO)和皮下注射(SC)外,还可以使用鞘内给药(intra-thecal drug delivery)、侧脑室给药(intra‑cerebroventricular delivery)和经鼻给药(trans-nasal drug delivery)等方式,目前认为这几种方式可以增加化合物入脑的比例。
通过NeuroPK获得的参数,经体外游离系数的折算以后,即可获得如下重要的参数:
Cb,u=Cb,t × fb,u;
Cp,u=Cp,t × fp,u;
AUCb,u=AUCb,t × fb,u;
AUCp,u=AUCp,t × fp,u;
Kp,uu=Cb,u/Cp,u = AUCb,u/AUCp,u
Kp,uu可以用来评估化合物的脑渗透性,以及评价化合物在血液和脑隔室中的游离化合物是否达到了平衡。
Kp,uu<1, Cb,u < Cp,u: 血浆和脑中的游离药物不平衡,可能存在BBB外排作用或者化合物BBB渗透性差,可考虑进行结构改造,改善渗透性或避免外排。
Kp,uu>1, Cb,u > Cp,u: 可能有BBB摄取转运体的参与;
Kp,uu≈1, Cb,u ≈ Cp,u: 血浆和脑中的游离药物浓度达到平衡,意味着可以用血浆中的游离药物浓度反映脑内的游离药物浓度。
此外,还可以计算AUCCSF:AUCp,u和ACUb,u:AUCCSF两个比值,前者可以评价化合物穿越BCSFB的情况,后者可以当血浆和脑中的游离药物不平衡时,评价使用CSF的数据是否可以用来评估脑中的游离药物浓度。
四、四个CNS药物研发中常见的误区
误区一
B/P ratio越高越好
B/P ratio=脑内化合物总浓度/血浆中化合物总浓度,可以通过NeuroPK获得。该参数没有区分结合化合物和游离化合物,它很大程度上受化合物与血浆或脑匀浆中蛋白质和脂质的非特异性结合影响。脑和血浆中游离化合物的比值 (Kp,uu 或者Cb,u/Cp,u)才是评价化合物对BBB渗透性的可靠指标。
误区二
为了提高brain unbound浓度,应该通过结构优化提高血浆和脑组织中的游离系数(fraction unbound, fb,u)
fb,u值不适合用来指导化合物的结构优化。Cb,u =Cb,t * fb,u。fb,u改变以后,Cb,t可能也随之改变[18]。因此体外的血浆蛋白结合实验以及脑组织匀浆结合实验并不推荐作为前期化合物筛选的依据和指标,只有当需要将体内的总化合物浓度转换为游离化合物浓度的时候,才需要去做血浆蛋白结合或者脑组织匀浆结合的测试。
误区三
CSF浓度可以代替Cb,u
如果没有转运体的参与,脑内游离药物浓度应该跟CSF中化合物浓度接近,此时可以使用CCSF来代替Cb,u。CCSF被认为在Cb,u (通过微透析检测得到)的三倍区间范围内[19]。
但对于转运体的底物来说,CSF浓度不能用来衡量Cb,u。BCSFB的外排转运体是将化合物转运到CSF方向的,因此此时的CCSF往往高于Cb,u。
另外,如果化合物主要通过BCSFB进入CSF的话,CSF浓度也会高于Cb,u,因为BSCFB的通透性高于BBB。此外,CSF并不是很均一的,而且CSF更新快(5h进入体循环更新一次),不同位点的CSF药物浓度可能不同,因此采样点也是一个重要的影响因素[20]。
误区四
CNS PK研究动物种属使用大动物,如猴,能更好地预测human的数据
对于没有转运体参与的化合物来说,Kp,uu在不同物种中数据近似,啮齿动物的Kp,uu也可以用来预测人脑内的游离化合物浓度[4]。例如,通过如下公式可以用大鼠的Kp,uu预测人脑内的游离化合物浓度:
[Cb,u,human ≈ Kp,uu,rat * Cp,u,human]
对于转运体底物来说,由于转运体存在物种差异,猴PK被认为能更好地预测人的脑暴露量[9]。
结语
基于CNS特殊的结构特点,开发CNS药物的难度非常大,如果能在前期正确地评价和筛选出性质良好的候选化合物,将有助于降低药物研发的失败率,大大地减少损失。在早期药物筛选过程中,结构优化和体外系统评价是一个循环往复的过程。在这个过程中,我们的目标就是降低化合物的外排比(ER)、减少系统代谢和清除、提高化合物的溶解度和BBB渗透性,为此,我们提出如下CNS药物早期筛选策略(图17)。
药明康德药物代谢与动力学部有着多年CNS药物评价的研究经验、专业的研究团队和完善的CNS药物体内外的评价平台,我们致力于为CNS药物研发贡献自己的力量,助力合作伙伴更顺利地推进CNS药物研发项目,为更多患者带来希望。
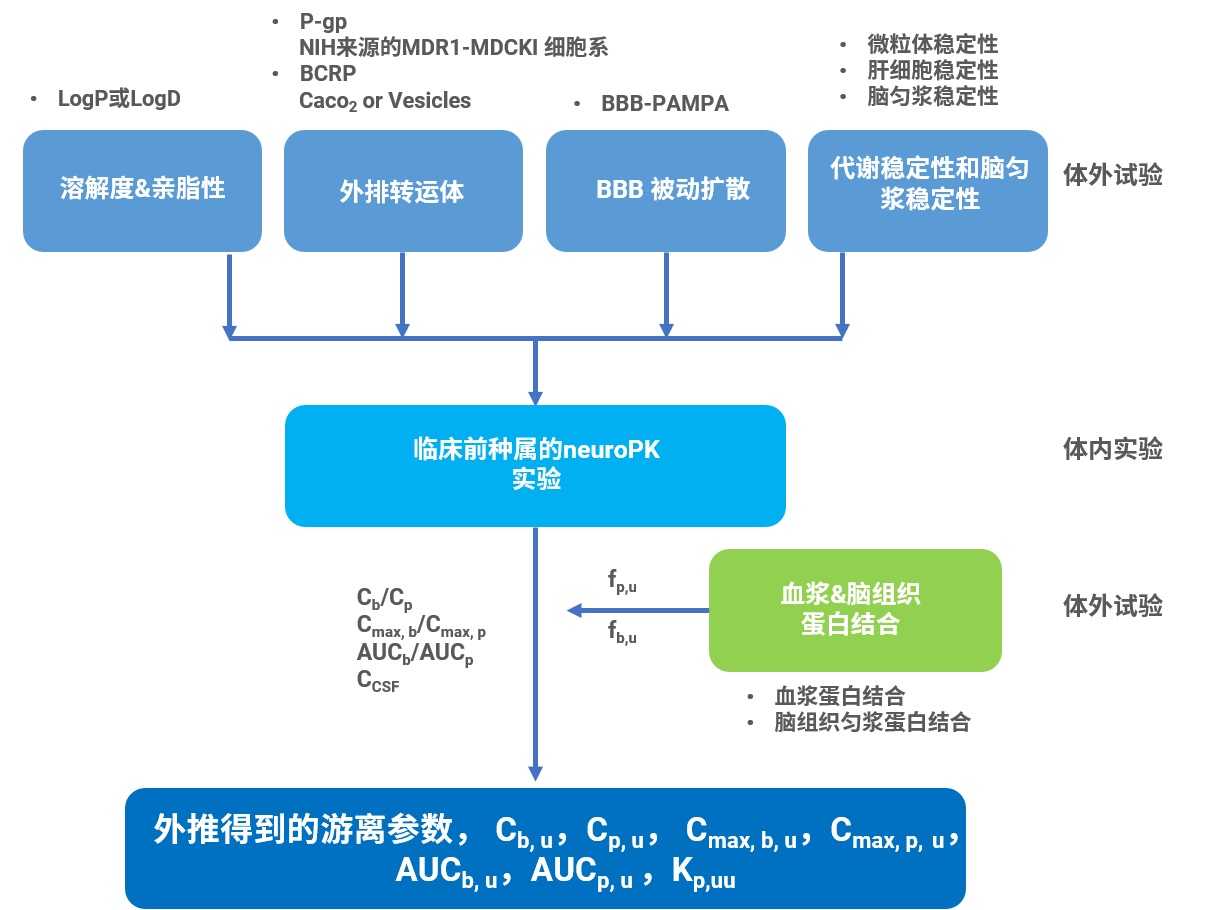
图17. CNS化合物的评价策略
作者:李惠惠,阮婷婷,刘青,熊涛,董轩,汤城,陈根富,金晶
编辑:方健,钱卉娟
设计:倪德伟,张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系。
参考
[1]http://www.hopkinsmedicine.org/health/conditions-and-diseases/overview-of-nervous-system-disorders
[2]http://www.who.int/publications/i/item/9789240049338 World mental health report: Transforming mental health for all (who.int)
[3]http://www.who.int/zh/health-topics/mental-health#tab=tab_2
[4]Di L, Rong H, Feng B. Demystifying brain penetration in central nervous system drug discovery. Miniperspective. J Med Chem. 2013 Jan 10;56(1):2-12. doi: 10.1021/jm301297f. Epub 2012 Nov 6. PMID: 23075026.
[5]2023年全球医药研发全景展望 - IQVIA
[6]Boonstra E, de Kleijn R, Colzato LS, Alkemade A, Forstmann BU, Nieuwenhuis S. Neurotransmitters as food supplements: the effects of GABA on brain and behavior. Front Psychol. 2015 Oct 6;6:1520. doi: 10.3389/fpsyg.2015.01520. PMID: 26500584; PMCID: PMC4594160.
[7]Georgieva, J.V.; Hoekstra, D.; Zuhorn, I.S. Smuggling Drugs into the Brain: An Overview of Ligands Targeting Transcytosis for Drug Delivery across the Blood–Brain Barrier. Pharmaceutics 2014, 6, 557-583. http://doi.org/10.3390/pharmaceutics6040557
[8]Guangzhe Li, Kun Shao, Channakeshava Sokke Umeshappa, 3 - Recent progress in blood-brain barrier transportation research, Editor(s): Huile Gao, Xiaoling Gao, Brain Targeted Drug Delivery System, Academic Press,2019, Pages 33-51, ISBN 9780128140017, http://doi.org/10.1016/B978-0-12-814001-7.00003-2.
[9]Li Di, Edward H. Kerns, Chapter 10 - Blood-Brain Barrier, Editor(s): Li Di, Edward H. Kerns, Drug-Like Properties (Second Edition), Academic Press, 2016, Pages 141-159, ISBN 9780128010761,
http://doi.org/10.1016/B978-0-12-801076-1.00010-1.
[10]Sanchez-Covarrubias L, Slosky LM, Thompson BJ, Davis TP, Ronaldson PT. Transporters at CNS barrier sites: obstacles or opportunities for drug delivery? Curr Pharm Des. 2014;20(10):1422-49. doi: 10.2174/13816128113199990463. PMID: 23789948; PMCID: PMC3913737.
[11]Di L, Kerns EH, Bezar IF, Petusky SL, Huang Y. Comparison of blood-brain barrier permeability assays: in situ brain perfusion, MDR1-MDCKII and PAMPA-BBB. J Pharm Sci. 2009 Jun;98(6):1980-91. doi: 10.1002/jps.21580. PMID: 18837012.
[12]Jiang L, Kumar S, Nuechterlein M, Reyes M, Tran D, Cabebe C, Chiang P, Reynolds J, Carrier S, Sun Y, Eddershaw P, Hay T, Chen W, Feng B. Application of a high-resolution in vitro human MDR1-MDCK assay and in vivo studies in preclinical species to improve prediction of CNS drug penetration. Pharmacol Res Perspect. 2022 Feb;10(1):e00932. doi: 10.1002/prp2.932. PMID: 35156331; PMCID: PMC8929335.
[13]Tsinman O, Tsinman K, Sun N, Avdeef A. Physicochemical selectivity of the BBB microenvironment governing passive diffusion--matching with a porcine brain lipid extract artificial membrane permeability model. Pharm Res. 2011 Feb;28(2):337-63.
[14]Drion, N et al. “Role of P‐Glycoprotein in the Blood‐Brain Transport of Colchicine and Vinblastine.” Journal of Neurochemistry 67 (1996): n. pag.
[15]A.M. Karssen, O.C. Meijer, E.R. de Kloet, Chapter 3.4 - Corticosteroids and the blood–brain barrier, Editor(s): T. Steckler, N.H. Kalin, J.M.H.M. Reul, Techniques in the Behavioral and Neural Sciences, Elsevier, Volume 15, Part 1, 2005, Pages 329-340,
[16]Taskar KS, Mariappan TT, Kurawattimath V, Singh Gautam S, Radhakrishna Mullapudi TV, Sridhar SK, Kallem RR, Marathe P, Mandlekar S. Unmasking the Role of Uptake Transporters for Digoxin Uptake Across the Barriers of the Central Nervous System in Rat. J Cent Nerv Syst Dis. 2017 Mar 15;9:1179573517693596. doi: 10.1177/1179573517693596. PMID: 28469522; PMCID: PMC5392048.
[17]Parkinson FE, Friesen J, Krizanac-Bengez L, Janigro D. Use of a three-dimensional in vitro model of the rat blood-brain barrier to assay nucleoside efflux from brain. Brain Res. 2003 Aug 8; 980(2): 233-41.
[18]Smith DA, Di L, Kerns EH. The effect of plasma protein binding on in vivo efficacy: misconceptions in drug discovery. Nat Rev Drug Discov. 2010 Dec;9(12):929-39. doi: 10.1038/nrd3287. PMID: 21119731.
[19]X. Liu, K. Van Natta, H. Yeo, O. Vilenski, P.E. Weller, P.D. Worboys, M. Monshouwer, Unbound drug concentration in brain homogenate and cerebral spinal fluid at steady state as a surrogate for unbound concentration in brain interstitial fluid, Drug Metab. Dispos. 37 (2009) 787–793.
[20]Shen, D. D.; Artru, A. A.; Adkison, K. K. Principles and applicability of CSF sampling for the assessment of CNS drug delivery and pharmacodynamics. Advanced Drug Delivery Reviews 2004, 56, 1825-1857.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息