免疫原性一般是指药物和/或其代谢物诱发对自身或相关蛋白的免疫应答或免疫相关事件的能力[1]。免疫反应的影响可以是无临床意义抗药抗体的出现,也可以严重到危及生命。免疫原性研究一直是药物研发的重要组成部分,贯穿药物研发-非临床研究-临床研究-上市后药物监测的整个生命周期。抗药抗体 (Anti-drug antibody, ADA)是药物免疫原性评价的主要方式。目前的大分子类型药物包括单克隆抗体(mAbs)、融合蛋白、重组蛋白、基因治疗产品、疫苗,特别是新型疫苗(如mRNA疫苗)、细胞治疗产品(如CAR-T细胞疗法)等,都是可能引起免疫原性的新分子类型。本文将从免疫原性的形成机制和影响因素、对药物研发产生的影响出发,介绍常用的检测免疫原性的策略、如何选取合适的分析平台和检测形式以及分析方法面临的挑战。
抗药抗体的形成机制
治疗性蛋白药物引起的机体免疫反应包括天然免疫和适应性免疫。天然免疫是生物体非特异性、无记忆性的病原体防御功能,用以抵御病原体入侵的第一道防线,特定的药物类型在特殊病人群体也可能诱导天然免疫系统的响应。而我们一般讨论与监测的更多是治疗性蛋白药物的适应性免疫反应。适应性免疫包括细胞免疫介导的细胞因子释放作用和体液免疫介导的抗药抗体的产生。
体液免疫主要通过B细胞产生的针对治疗性蛋白的抗药抗体来发挥作用。抗药抗体不仅包括结合药物的抗体,也可以是阻断其功能的中和抗体。如图1所示,根据产生机制通常可分为T细胞依赖途径和非T细胞依赖两种机制。实际上,由于免疫复合物或者聚集物都能够从不同程度上激活这两种途径,并且两种途径均会产生ADA,使得这两种机制并无明显区别,它们会相互作用并增加对方的作用强度。

图1. 抗药抗体的产生机制[2]
免疫原性产生因素及对药物研发的影响
ADA的产生最初与第一批上市抗体含有大量的小鼠序列有关。它们被人体免疫系统识别为异物是免疫原性出现的关键步骤。为了解决该问题,生物工程的进步产生了嵌合(鼠-人)抗体、人源化抗体和全人源抗体[3]。然而,尽管免疫原性降低,但并没有完全消除。免疫原性的产生是由多因素共同作用的结果,可以分为与患者相关的因素(患者的免疫力状态和免疫能力、遗传因素、预存抗体、给药途径、剂量和频率)和与药物相关的因素(产品的来源、结构、聚合物的形成、糖基化、聚乙二醇化、杂质、处方、包装和储存等)。美国药典通则1106对这些影响因素进行整理归纳,主要可以分为低、中、高风险3个方面。
表1. 影响免疫原性产生的因素[4]
较低发生率 | 中等发生率 | 较高发生率 | |
循环中的内源性对照水平 | 丰富 | 稀少 | 无 |
患者的免疫状态 | 抑制 | 正常 | 激活 |
暴露量:给药方案或频率 | 单次给药 | 慢性(维持) | 不定期给药 |
多次给药 | |||
给药途径 | 静脉或口服 | 皮下、肌肉内、粘膜(非吸入) | 皮内或吸入 |
产品特性 | 产品或过程相关杂质(如聚集或变性、降解)水平最低(或不存在) | 产品或过程相关杂质(如聚集或变性、降解) 水平中等 | 产品或过程相关杂质(如聚集或变性、降解)水平高 |
活性物质的分子完整性保持 | 抗原表位水平高 (来源与小鼠细胞系,包含新的突变序列等) | ||
潜在T细胞表位低或无含量 | |||
机制:免疫抑制 | 机制:免疫激活 |
ADA 会对药物暴露、药物代谢动力学特征、药效、药物毒性作用等造成影响。ADA与药物结合,可能会增加或减少药物的清除、影响半衰期和组织分布、改变药物的暴露水平和药代动力学特征、影响对药物毒性作用的评价及对临床研究中起始剂量的评估;中和抗体会中和药物的活性、降低药物的药效作用;ADA与药物及相似内源性蛋白(具备相似表位)结合后,可能会导致该蛋白缺陷综合征,引起相应毒性作用;对药物的免疫应答可能会导致过敏反应、自身免疫等,ADA-药物免疫复合物沉积可能引起免疫病理变化和相关不良反应[5]。
免疫原性检测策略
对于ADA的检测,NMPA、FDA、EMA的指导原则均从免疫原性的检测流程维度分为筛选、确证和表征3个阶段。如图2所示,首先对所有样品进行筛选试验,其次对阳性样品的特异性进行确证试验,对已确定的阳性样品进行滴度试验,以及通过功能性试验对抗体中和活性进行检测。其中在已确定的阳性样品中,还应考虑确定抗体同种型、亚型和结合表位的检测。3个指导原则对于方法学验证的参数基本相同,但NMPA和FDA的指导原则给出了更加具体的要求和做法,而EMA相对宽泛。ADA检测的方法学验证内容通常包括筛选临界值、确证临界值、分析方法灵敏度、精密度、选择性、药物耐受性、特异性、稳健性、重现性及稳定性等,表2总结了3种指导原则需要的验证参数。
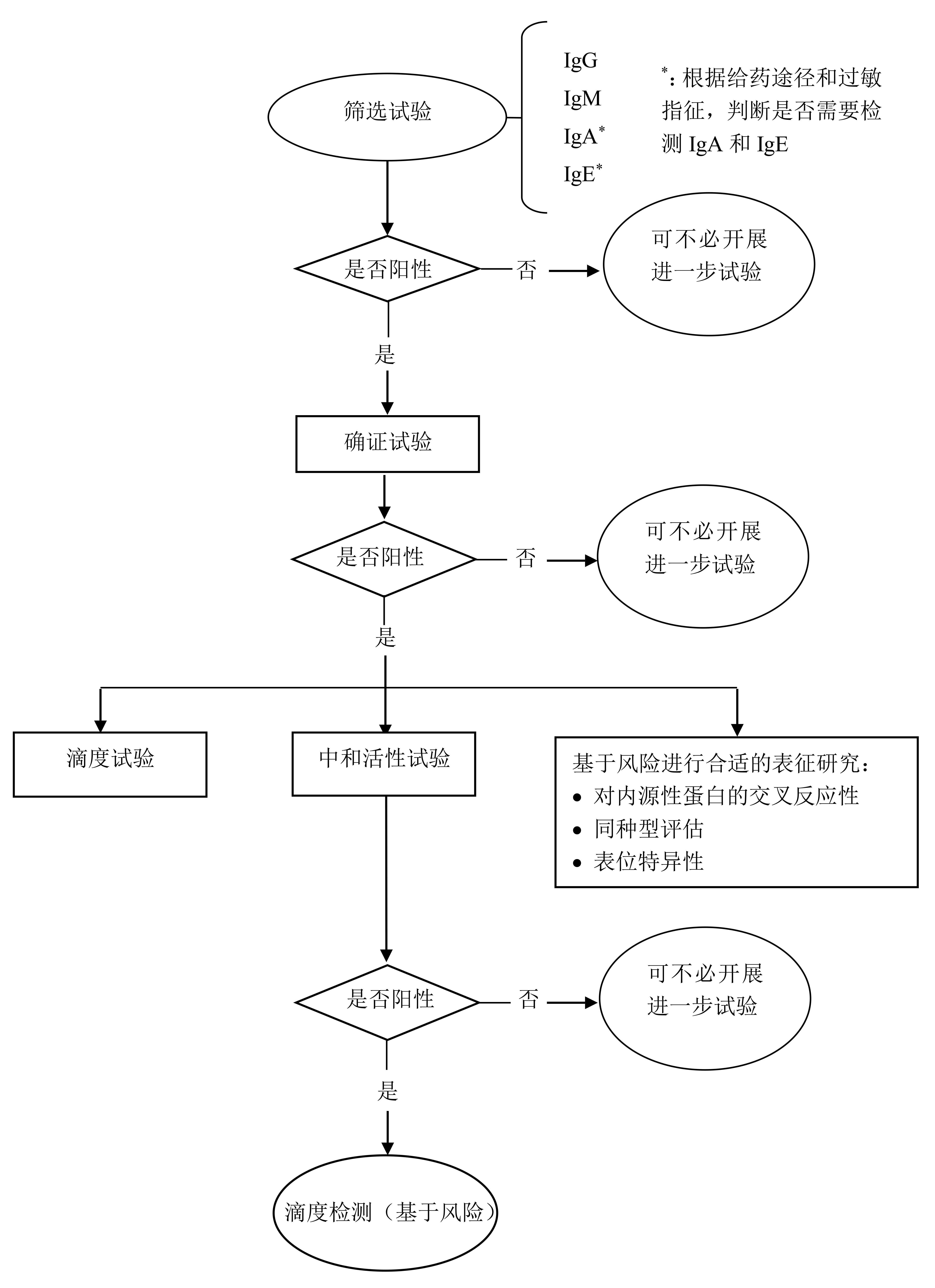
图2. ADA检测的分级评估策略[1]
表2. 3种指导原则验证参数的比较汇总[6-8]
类型 | 验证参数 | NMPA/2021 | FDA/2019 | EMA/2017 |
ADA试验 | 筛选临界值 | + | + | + |
确认临界值 | + | + | + | |
方法灵敏度 | + | + | + | |
药物耐受水平 | + | + | + | |
精密度 | + | + | + | |
特异性 | + | + | + | |
选择性 | + | + | + | |
钩状效应 | + | + | - | |
MRD | + | + | + | |
重现性 | + | + | - | |
稳健性 | + | + | + | |
稳定性 | + | + | - |
注:+:有相关参数 -:无提及
对于细胞因子释放试验,EMA并未要求,FDA也仅是简单提及,而NMPA首次将体外细胞因子试验提到法规层面,对体外细胞因子试验的策略、基本观察指标做了要求:基于细胞因子释放机制,设计合适的体外细胞因子释放试验,如果药物直接靶向免疫细胞,可采用外周血单个核细胞进行试验,如果机制可能与FcγRs结合相关,则更适合在包含表达FcγRs细胞的全血中进行试验,观察指标包括但不限于IL-2、IL-6、IL-10、IFN-γ和TNF-α[1][6][7][8]。
检测平台和检测形式的选择
由于免疫原性会严重影响药物的有效性和安全性,药监部门要求所有治疗性蛋白药物都要进行免疫原性检测,FDA对其给出的具体要求是高灵敏度、高特异性、高稳定性及高亲和力。而ADA的检测和确认比较复杂,检测结果会受到所使用的分析方法的影响。包括酶联免疫法(ELISA)、电化学发光法(ECL)、放射免疫沉淀法(RIPA)和表面等离子体共振法(SPR)。根据表3所列出的各平台分析方法的优缺点,可以挑选出合适的分析平台,规避可能出现的问题。
表3. 各免疫原性分析平台优缺点对比
类型 | 优点 | 缺点 |
直接/间接ELISA | 高通量 | 可能存在高背景 |
易于获得 | 可能不够特异 | |
易于自动化 | 效用依赖于检测不同lg亚型的能力 | |
价格便宜 | 固相-ELISA的药物耐受性较低 | |
读数可以提高灵敏度(如电化学发光) | 过度洗涤可能降低亲和力低的ADA检测 | |
溶液相-ELISA的药物耐受性较高 | ||
桥接法 | 低背景 | 很难去确认了lgM的存在 |
高度特异 | 需要标记产品 | |
易于获得 | 由于在配体和检测物之间的单臂结合减少了检测低亲和力抗体以及lgG4的能力 | |
易于自动化 | ||
价格便宜 | ||
可以跨物种使用并检测所有亚型 | ||
可用于多种检测平台(如比色法、电化学发光等) | ||
表面等离子体共振/生物层干涉测定法 | 灵活性强,可以表征免疫反应(浓度和相对亲和力) | 技术昂贵 |
药物耐受性更高,能够检测低亲和力抗体 | 供应商有限 | |
通量量适中 | ||
放射免疫沉淀检测法 | 价格便宜 | 放射性废物 |
高灵敏度 | 由于半衰期短需要频繁重新标定放射性试剂 | |
更适合高亲和力抗体 | 对于低亲和力抗体的实用性可能较低 |
另外,FDA在2018年统计了当时近五年的申报方法,其中ADA的检测以ECL和ELISA平台为主,中和抗体检测以细胞实验和竞争配体结合实验平台为主。在检测形式上又分为直接法和桥接法。
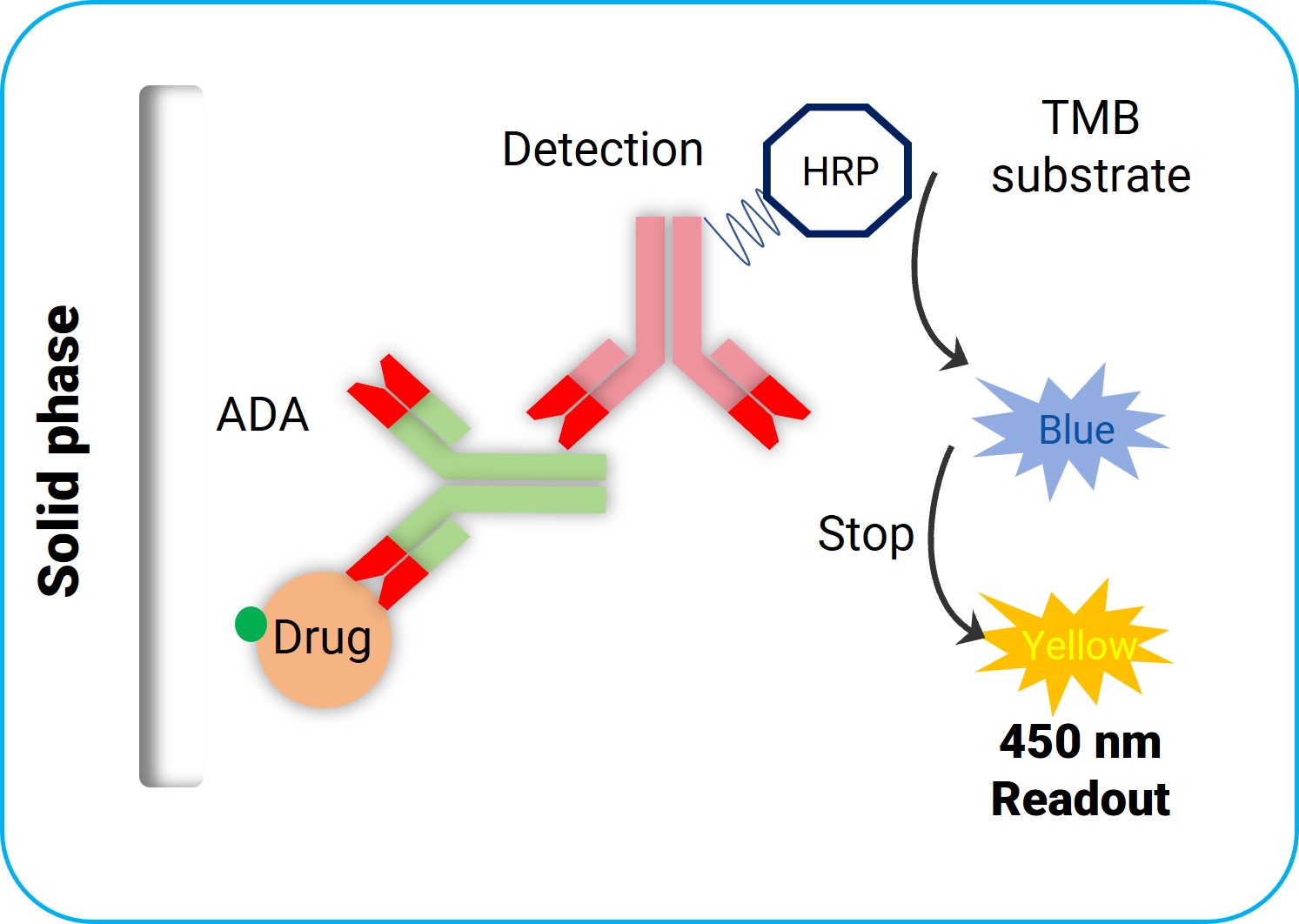
图3. ELISA直接法示意图

图4. ECL桥接法示意图
案例分享
在内部验证试验中,采用ECL桥接法检测了曲妥珠单抗给药后大鼠体内产生的抗药抗体。该方法对筛选临界值、确证临界值、分析方法灵敏度、耐药性、精密度、选择性、稳定性等参数进行了确证。其中灵敏度可做到0.382 ng/mL,耐药性可做到阳性对照为500 ng/mL时可耐受200 μg/mL。
实验入组共6只大鼠,采用交叉取点的方式,采集了8个时间点,共24个样本。首先通过筛选试验确认了8个样本为阳性,再通过确证实验确定4个样本为假阳性,最后通过titer实验来表征抗体的相对含量,结果显示这4个样本滴度从10200-68000不等。
表4. 曲妥珠单抗给药后大鼠体内试验结果汇总
样本名称 | 筛选阴性或阳性 | 确证阴性或阳性 | 滴度 |
R01 168h | 阴性 | / | / |
R01 336h | 阴性 | / | / |
R01 672h | 阴性 | / | / |
R01 1008h | 阳性 | 阴性 | / |
R02 168h | 阴性 | / | / |
R02 336h | 阳性 | 阴性 | / |
R02 672h | 阳性 | 阳性 | 40800 |
R02 1008h | 阳性 | 阳性 | 68000 |
R03 168h | 阴性 | / | / |
R03 336h | 阳性 | 阴性 | / |
R03 672h | 阳性 | 阴性 | / |
R03 1008h | 阴性 | / | / |
R04 96h | 阴性 | / | / |
R04 264h | 阴性 | / | / |
R04 504h | 阴性 | / | / |
R04 840h | 阴性 | / | / |
R05 96h | 阴性 | / | / |
R05 264h | 阴性 | / | / |
R05 504h | 阳性 | 阳性 | 10200 |
R05 840h | 阴性 | / | / |
R06 96h | 阴性 | / | / |
R06 264h | 阴性 | / | / |
R06 504h | 阴性 | / | / |
R06 840h | 阳性 | 阳性 | 27200 |
注:/:未进行该实验
免疫原性分析方法的挑战
作为评估方法学性能的关键试剂,阳性对照抗体直接影响检测方法的灵敏度和药物耐受水平。选择合适的阳性对照抗体,对抗药抗体检测方法学的开发和验证至关重要。一般选择免疫动物制备多克隆抗体作为阳性对照抗体。
治疗性蛋白药物由于给药剂量大、半衰期长,循环中的高浓度药物给免疫原性的评估带来了很大挑战。ADA检测会受到样品基质中药物的干扰,过量的药物与 ADA 结合,会造成 ADA 检测假阴性结果。目前在ADA分析中,有多种方法可以用来提高药物耐受性,减少或避免由于游离药物的存在而造成的假阴性结果,防止对ADA的低估。由于ADA在样品中会有两种存在形式,即游离ADA和ADA-药物复合物[9]。为了减少在ADA检测过程中受到的各种干扰,需要对样品进行前处理,应该考虑每种药物的特点、检测目的、风险评估、灵敏度目标、操作难易程度及可行性等,选择适用的分析方法。如表5所示,我们对比了不同处理方法对药物耐受性的影响。
表5. 不同处理方法药物耐受性对比
预处理方法 | 药物耐受性(阳性对照浓度 250 ng/mL) |
酸解离 | 20 μg/mL |
亲和捕获提取(ACE) | 50 μg/mL |
固相提取和酸解离(SPEAD) | 100 μg/mL |
磁珠提取和酸解离(BEAD) | 500 μg/mL |
沉淀和酸解离(PandA) | 1000 μg/mL |
另外,对于单抗药物,可溶性靶标的干扰也是一个具有挑战性的问题。可溶性的二聚体或多聚体药物靶标可以在两个标记药物分子之间形成桥梁,容易导致ADA假阳性结果。而当只能与其中一种抗体结合时,又会造成空间位阻,导致假阴性结果的产生。目前通常采用的解决方法是将基质中的可溶性靶点进行清除,通常可以用靶点抑制剂(一般为相应的抗靶点抗体)去结合靶点,可去除靶点的干扰作用,提高靶点耐受性[10]。
结语
随着科技的进步,新的治疗性蛋白药物和治疗方式必将成为医药产业的焦点,而免疫原性仍然是生物疗法发展中要面对的一个重要问题。作为一种跨学科的方法,免疫原性评估需要生物分析、生物化学、免疫学、肿瘤学、药理学等多学科的密切配合。药明康德DMPK具备丰富的临床前生物分析经验,目前在大分子生物分析上,已承接了大量单/双/多特异性抗体、ADC、抗体片段/抗体前药、寡核苷酸、PEG蛋白/肽段等类型生物药的免疫原性分析工作。可以帮助客户快速完成临床前免疫原性生物分析方法的建立和确证,满足药代动力学的FDA/NMPA/TGA的IND申报要求。
作者:宋苗苗,刘洁,周毛天,邢丽丽
编辑:富罗娜·克里木,钱卉娟
设计:倪德伟,张莹莹
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系。
参考
[1] 国家药品监督管理局药品审评中心“药物免疫原性研究技术指导原则”,2021年3月
[2] Ulitzka M., Carrara S. C., Grzeschik J., et al. Engineering therapeutic antibodies for patient safety: tackling the immunogenicity problem[J]. Protein Engineering Design and Selection, 2020: 33
[3] Singh, Surjit, et al. "Monoclonal antibodies: a review." Current clinical pharmacology 13.2 (2018): 85-99.
[4] <1106> Immunogenicity Assays - Design and Validation of Immunoassays to Detect Anti-Drug Antibodies
[5] Michael Ulitzka, Stefania Carrara, Julius Grzeschik, Henri Kornmann, Björn Hock, Harald Kolmar, Engineering therapeutic antibodies for patient safety: tackling the immunogenicity problem, Protein Engineering, Design and Selection, Volume 33, 2020, gzaa025, http://doi.org/10.1093/protein/gzaa025
[6] Guidance for Industry Bioanalytical Method Validation. US Department of Health and Human Services, Food and Drug Administration Center for Drug Evaluation and Research, Center for Veterinary Medicine. May 2018.
[7] Draft ICH Guideline M10-Bioanalytical Method Validation (EMEA/CHMP/EWP/172948/2019). March 2019
[8] EMA Guideline on bioanalytical method validation (EMEA/CHMP/EWP/192217/2009), adopted 21 July 2011
[9] Gunn GR, Sealey DC, Jamali F,Meibohm B,Ghosh S,Shankar G. From the bench to clinicalpractice:understanding the challenges and uncer⁃tainties in immunogenicity testing for biopharma⁃ceuticals[J]. Clin Exp Immunol,2016,184(2):137-146.
[10] 邵雪,洛文靖,王海学,等.可溶性靶点分子对生物制品抗药抗体桥连法检测的挑战和应对策略[J].中国药理学与毒理学杂志, 2019, 33(11):6.DOI:10.3867/j.issn.1000-3002.2019.11.011.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息