手性化合物在自然界和生物环境中普遍存在,天然糖、核酸、淀粉和纤维素、蛋白质和氨基酸等很多是手性的[1]。手性化合物在空间中呈镜面上的对称,但是无法通过空间上的旋转达到完全重合(图1)。许多有机化合物分子都有“对映体”,即具有“手性”。
对于一对手性药物的对映异构体,其药效活性和药代动力学性质可能存在显著差异。为了评估单个对映体的活性、毒性、吸收、分布、代谢和排泄(Activity, Toxicity, Absorption, Distribution, Metabolism and Excretion)特性,以及在生物体系或生物体内可能的手性反转,生物样本中手性化合物的分析对于单个对映体和/或其代谢物的评价是非常必要的。

图1. 1, 2-丙二醇的两种手性对映体[2]
一、手性药物不同构型的不同效用
手性药物的不同构型有不同的效用,因此在临床上有不同的应用。沙利度胺(Thalidomide)R-对映体具有抑制妊娠反应和镇静作用,而S-对映体则有致畸性。人们认识到结构相似的两个手性对映体在生物体内的作用会有如此大的差异,并且随着对其药理作用机制的深入研究,沙利度胺被证实有较强的免疫调节、抑制血管形成作用,基于安全性考虑,目前该药物用于特定人群的免疫和肿瘤相关疾病的治疗[3]。乙拉西坦中只有S-对映体(左乙拉西坦)具有生物活性,而R-对映体没有生物活性[4],目前临床上左乙拉西坦主要用于成人及4岁以上儿童癫痫患者部分性发作的加用治疗。
二、对手性化合物认识与监管的发展
各国药品监管机构制定了手性药物研发相应的政策和具体的指导方针(表1),制药企业需要遵循严格的监管要求,以确保药品的安全。
表1. 各国监管机构对手性药物要求
美国FDA | Development-new-stereoisomeric-drugs[5]对于具有手性结构的药物要求说明左、右旋药效和毒性试验,才允许上市。药物的异构体必须分离,研究人员必须提供其药理学、毒理学和药代动力学结果。 |
欧洲EMA | 在欧洲药典EP7.0(2010版)[6]中,共有1350种化合物,其中手性药物占50%左右,要求对特定构型的对映体进行研究。 |
日本PMDA | 日本药典(药局方)15版(The Japanese Pharmacopoeia Fifteenth Edition)[7],不完全统计共有约900种化合物,其中对手性构型有特定要求的手性药物约占一半,要求对其药效进行研究。 |
中国NMPA | 在中国药典2010年版[8]中,不完全统计包括1020种不同结构的药物,其中,具有手性中心的药物占全部药物的40%左右。 |
三、手性药物药代动力学研究策略
手性药物的立体异构性可能导致其在药效学和/或药代动力学性质上表现出很大差异。也就是说,一种对映异构体可以作用于靶标,而另一种对映异构体可能是无活性的,甚至可能是有害的。因此对于测量生物样品中单个对映异构体和/或其手性代谢物的浓度是十分必要的,以评估单个对映异构体的吸收、分布、代谢、排泄和毒性。此外,还需要手性测定来评估在生物体内由于生物转化过程引起化合物潜在的手性反转,从而正确评估手性化合物的药效活性,药代动力学特性以及相关的毒性。
与非手性药物测定相比,手性药物测定的方法开发和验证相对更具有挑战性。因此,应使用专门的解决方案来满足手性药物开发的不同场景中出现的特定需求(图6),包括外消旋体及单一对映异构体的方法开发、外消旋体转换及对映异构体代谢物的定量,并且基于开发策略和候选药物的分子特性,选用合适的手性色谱柱(图2),对手性药物进行定性或定量分析[9]。
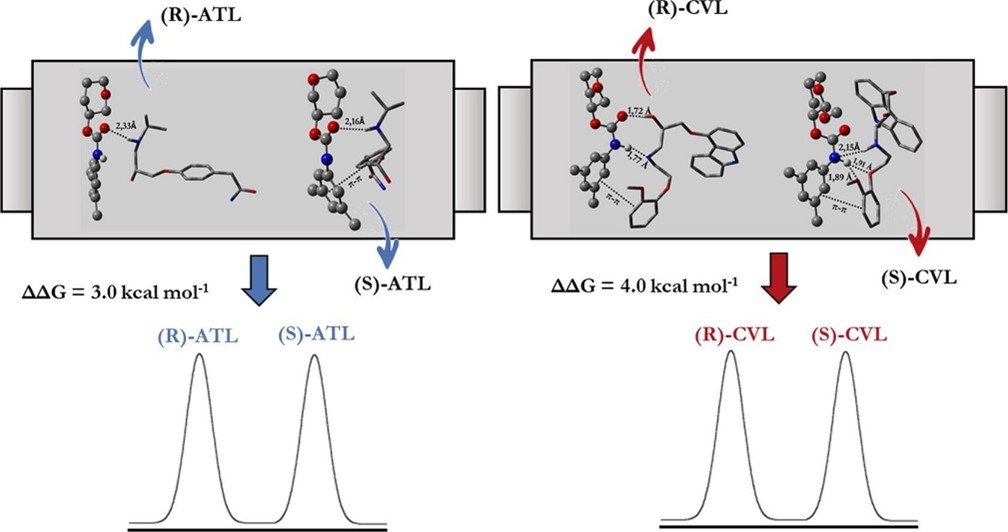
图2. 多糖衍生固定相与两种β受体阻滞剂药物阿替洛尔(ATL)和卡维地洛(CVL)的手性识别过程[10]
同时手性方法可快速进行手性对映体转换研究。例如文献中报道[11]在三种动物中进行GNE-C给药,而后测定6h后各种属血浆中药物含量。从图3可知,小鼠给药6h后,其血浆中出现GNE-C的对映体GNE-C*,而在大鼠和狗的血浆中GNE-C到GNE-C*没有发生手性反转。
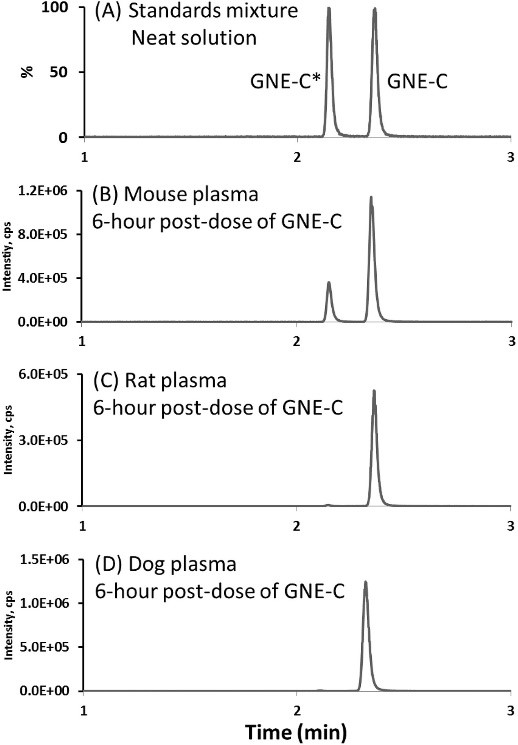
图3. (A) 纯溶液的标准混合物中GNE-C和GNE-C*的手性SFC-MRM色谱图。(B) GNE-C给药后6小时后的小鼠血浆。(C) GNE-C给药后6小时后的大鼠血浆。(D) GNE-C给药后6小时后的狗血浆[11]

图4. 手性药物药代动力学研究策略[12,13]
对于手性化合物的药代动力学研究,可先进行体外转化的研究,更多的了解化合物在各种生物基质和环境下的转换状态,再评估在其体内的药代和转换特性。如果没有先行的体外实验的研究,在手性化合物的初步药代动力学动物体内实验中,也可以采用手性的方法对样品进行各时间点的监测,从而直接了解化合物的转换和代谢特性。
四、手性药物在生物样品中的分析挑战
在临床前和临床研究中,手性化合物的检测是至关重要的,与非手性药物药代动力学研究相比,手性药物药代动力学研究在分析上极具挑战性,主要体现在以下几个方面:
对映体药物特性
手性药物对映体在一定理化或生理条件下可能会发生相互转换,需要优化前处理方式;
一对对映体药物可能表现出不同的PD和PK特性 ,导致样品中浓度差异较大,样品处理方式可能会不同。
色谱分离困难
由于手性药物的对映体结构相似,在质谱端母离子和子离子完全相同,因而在色谱端对映体必须基线分离才能对其进行准确的定性和定量;
手性色谱柱筛选,优化流动相。
其他生物分析挑战
生物样本体积少、基质多样(血浆、组织)且复杂;
在实现手性分离的前提下,对灵敏度和检测速度均有较高要求;
部分实验中生物样品数量多,且在处理过程中不能有手性转化发生。
五、手性药物分析技术路线
随着分析技术的不断进步,目前常见的手性药物的分离手段包含气相色谱、液相色谱、超临界流体色谱以及合相色谱(图5):

图5. 手性药物的主要分析方法[14]
气相色谱(Gas Chromatography,GC)适用于沸点低和易挥发的手性药物,与液相对映体分离技术相比,GC与水样的兼容性较差、手性固定相选择非常有限,在生物分析中吸引力较低。
液相色谱(Liquid Chromatography,LC)具有高自动化和良好的重现性,高效液相色谱模式如正相(NP)、反相(RP)、亲水相互作用色谱(HILIC)等,增强了该技术对各类手性分析物的适用性。
超临界流体色谱(Supercritical Fluid Chromatography,SFC)超临界流体为流动相,可通过加入改性剂(如甲醇等)调节流动相的极性,从而达到分离化合物的目的。
合相色谱(Convergence Chromatography,CC)它结合了气相色谱的低粘度、高扩散性以及液相色谱的适用性广等优势,是SFC的升级版,以超临界二氧化碳流体结合部分溶剂为流动相,根据各个化合物在固定相和流动相之间的分配系数不同而进行分离。
六、DMPK手性药物分析技术平台
在新药研发中,化合物的手性分析和研究势在必行。手性化合物的检测物类型日益复杂,评估范围也从浓度检测扩展到代谢产物的鉴定,尤其是引入PROTAC(Proteolysis-Targeting Chimera)药物、小肽、ADC和PDC等药物和其他生物制品,对生物分析的手性分离和方法的稳定性提出新的挑战,因此建立准确可靠、高通量的手性药物分析技术平台至关重要。

图6. 药明康德DMPK手性药物分析技术平台
针对手性药物的分离和检测,药明康德测试事业部药物代谢与动力学部拥有两个手性分析技术平台,分别是UPLC-MSMS和UPCC-MSMS分析技术平台,覆盖常规小分子药物和多肽药物,可提供手性对映体分离、手性药物在生物样品中的检测、手性药物对映体转换研究。现已为多对手性药物进行快速分离和检测,并成功进行了ADME体外及PK体内的各项试验(图7)。药物代谢与动力学部Non-GLP分析团队经验丰富,能力全面,为客户的手性药物设计药代动力学研究策略,并及时优化调整,助力加快新药研发进程。
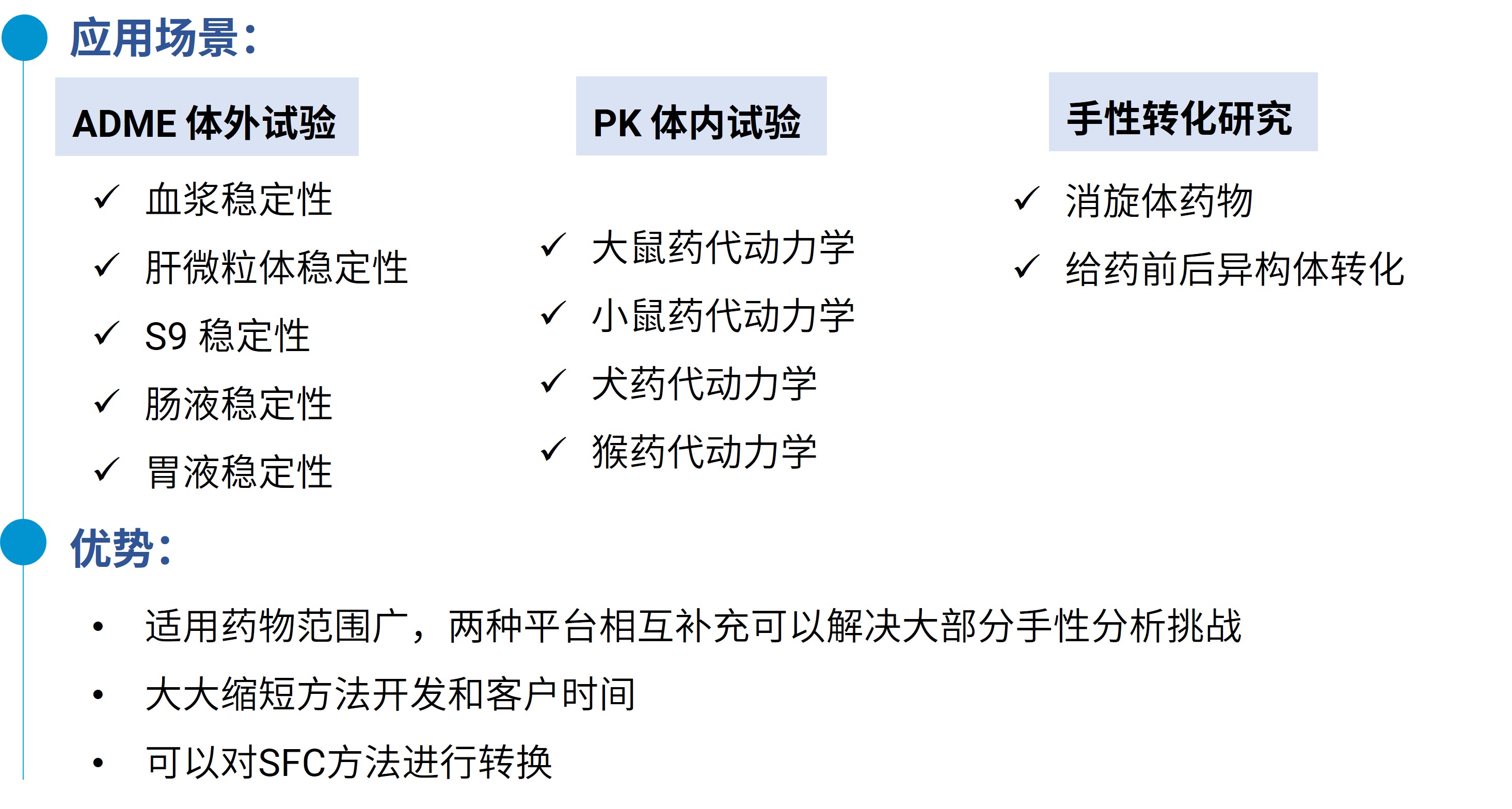
图7. 药明康德DMPK两种手性药物分析技术平台优势和应用场景
结语
随着手性药物数量的逐年增长、多手性中心药物和多肽类手性药物方法开发难度增加,快速高效分离手性药物具有重要意义。根据申报要求,外消旋体和手性对映体需要在药理学、毒理学和药代动力学等方面进行评估。药明康德DMPK已经成功搭建两种手性药物分析技术平台,已完成数百个手性药物药代动力学分析案例,可以帮助客户设计手性药物的药代动力学研究策略,赋能药物早期筛选、临床前开发和临床阶段,助力快速推进药物研发流程。
作者:曲栗,王洪梅,邢丽丽
编辑:方健,钱卉娟
设计:倪德伟
药明康德DMPK依托中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1600家全球客户,具有超过十五年的新药申报经验,已成功支持超过1700个新药临床研究申请(IND)。
点击此处与我们的专家进行联系。
参考
[1] Grybinik S, Bosakova Z. Correction to: An overview of chiral separations of pharmaceutically active substances by HPLC (2018-2020)[J]. Monatsh Chem., 2021, 152:1033-1043.
[2] Patterson D, Schnell M, Doyle J M.et al. Enantiomer-specific detection of chiral molecules via microwave spectroscopy[J]. Nature, 2013, 497(7450),475-477.
[3] Raje N, Anderson K. Thalidomide-a revival story[J]. The New England Journal of Medicine, 1999, 341:1606-1609.
[4] 杨建,石卫兵,黄书卷. 合成乙拉西坦的方法改进,合成化学,2009年第17卷第1期,118-119.
[5]http://www.fda.gov/regulatory-information/search-fda-guidance-documents/development-new-stereoisomeric-drugs
[6] http://www.edqm.eu/en/
[7] http://www.drugfuture.com/Pharmacopoeia/JP15/JP15e.html
[8] http://www.chp.org.cn/gjyjw/ydjj/1265.html
[9] Jian W, Edom R W, Huang M Q, et al. Bioanalysis of chiral compounds during drug development using a tiered approach [J]. Bioanalysis, 2014, 6(5):629-639.
[10] Maia P P, Nascimento C A, Silva C F, et al. Chiral separation study of atenolol and carvedilol β-blocker drugs by DFT calculations[J]. Computational and Theoretical Chemistry, 2022,1213: 113741.
[11] Chen L, Dean B, La H, et al. Stereoselective supercritical fluidic chromatography –mass spectrometry (SFC-MS) as a fast bioanalytical tool to assess chiral inversion in vivo and in vitro[J]. International Journal of Mass Spectrometry, 2019, 444:116172.
[12] Barreiro J C, Tiritan M E, Cass Q B. Challenges and innovations in chiral drugs in an environmental and bioanalysis perspective [J]. TrAC Trends in Analytical Chemistry, 2021, 142:116326.
[13] Calcaterra A, Acquarica I. The market of chiral drugs: Chiral switches versus de novo enantiomerically pure compounds, Journal of Pharmaceutical and Biomedical Analysis, 2018,147:(323-340).
[14] Ribeiro A, Maia A S, Ribeiro C, et al. Analysis of chiral drugs in environmental matrices: Current knowledge and trends in environmental, biodegradation and forensic fields[J]. TrAC Trends in Analytical Chemistry, 2019, 124:115783.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息











