新药研发主要分为四个阶段:新药发现(Drug Discovery)、临床前研究(Preclinical Research)、临床研究(Clinical Research)和新药申请(New Drug Application,NDA),不同开发阶段的研究对象与研究目标不同,对于制剂的开发策略也不同,本文主要描述了药物临床前研究阶段的制剂开发策略。
临床前研究主要包括药代动力学(Pharmacokinetics, PK)、药效学(Pharmacodynamics, PD)和毒理学(Toxicology, TOX)等研究,除常规体外研究外,体内研究可以更好地评估供试品的性质。临床前动物体内研究目标不同,其制剂开发策略也有所不同[1]:如临床前动物实验研究目标是为了获得较高口服生物利用度,相对混悬剂,优化后的澄清溶液剂可获得最大药物暴露量,获得较高的生物利用度,并可减少个体间变异;若研究目标是探索候选药物开发成为市售产品的可行性,则需要使用溶液剂、混悬剂或固体制剂类型来评估高或低溶解度以及溶出度对体内暴露的影响,且制剂开发需考虑更多因素,处方工艺等设计一般也更为复杂[2]。因此,为满足药代动力学,药效学和毒理学等研究的需求,需要采用不同的制剂策略来进行临床前制剂开发。
一、药代动力学研究中制剂开发策略
整体上,药物早期发现阶段,经理化性质和DMPK体外评估筛选得到候选化合物后,会先在啮齿类动物上开展PK研究以初步评估候选化合物体内的ADME性质,并从中挑选出优质化合物进入到下一个阶段的研究和开发。Allen C.等出版的《Discovering and Developing Molecules with Optimal Drug-Like Properties》一书中对于基于啮齿动物早期PK研究决定药物是否可以进行到下一步的决策树进行了详细描述,见图1[3]。

图1. 基于早期啮齿动物PK研究的药物研发决策树
在候选化合物分子开发早期阶段,化合物的物理化学性质如粒度分布、晶型、形态等会随分子优化的过程而发生变化,而这些变化会影响化合物的溶解度、溶出速度、体内吸收程度及生物利用度等,产生不同的PK结果。如下图2[4]默克公开披露数据,将MK-0869 (Aprepitant) 制备成粒径分别为了5.5 µm、1.8 µm、0.48 µm和0.12 µm的化合物粉末,将不同粒径的粉末分散在混悬液后以2 mg/kg剂量给予比格犬,结果显示化合物粒径越小,在比格犬体内的暴露量越高。

图2. 粒径对血药浓度的影响
图3[5]为赛诺菲公开披露的化合物晶型对PK特性的影响。左图为同一化合物的两种不同晶型在37℃下溶液中的溶解度结果,右图为两种不同晶型经十二指肠给药后的PK结果。实验结果显示,化合物晶型b的体外溶解度高于晶型a,相应的体内暴露量也高于晶型a。

图3. 晶型对血药浓度的影响
因此,用于早期PK研究的制剂配方最好选用溶液剂以消除化合物本身的溶解度、晶型、粒径、油水分配系数等性质对动物体内吸收的影响。
在溶液剂开发过程中,需要同时注意供试品在体内生理条件下的稳定性。可以在体外模拟生理介质中对溶液剂进行快速稀释试验,例如将溶液剂用磷酸盐缓冲液、模拟胃液和模拟肠液进行1:1、1:5和1:10稀释,考察其是否会发生沉淀,以便于更好地评估供试品在体内的溶解状态,预测供试品体内暴露情况。
如果供试品体内暴露量低,则需要根据具体的影响因素(渗透性、代谢等),进行对应的结构修饰和化合物优化。若溶液剂中化合物具有极好的体内暴露,则应采用混悬剂进行如下PK研究:评估开发成固体制剂的可行性;预测毒性试验的体内暴露;测定最大耐受剂量下的暴露量。如果化合物的溶液剂具有极好的暴露,而混悬剂的暴露量低,则可通过行星式球磨仪、高压均质机等先进设备将化合物微粉化或纳米化降低粒径,修饰物理性质来提高供试品体内暴露量[5]。
如下图4[6]所示,将化合物开发成共溶剂、湿法球磨混悬液、纳米晶后分别用于大鼠口服给药,不同制剂形式呈现出的PK特性不同。与30 mg/kg混悬液相比,20 mg/kg共溶剂以澄清溶液状态给药,澄清溶液状态有助于化合物的体内吸收,即使给药剂量低于混悬液,却可获得较高的体内暴露;混悬液与纳米晶制剂的给药剂量相同(30 mg/kg),但经纳米化的制剂能进一步降低粒径,从而优化其物理性质,进一步提高化合物的体内暴露量。

图4. 不同制剂形式对血药浓度的影响
另外,此阶段需要筛选大量化合物,但化合物量一般较少(1-5mg),且制剂配方交付周期紧张(24-48 h),为每种化合物开发最优的制剂配方不太合适。因此,制药公司通常会开发一组含有3-4种辅料的制剂配方用于相同或不同系列化合物的PK研究,其中含有不同的共溶剂(如二甲基乙酰胺、N-甲基吡咯烷酮、乙醇、丙二醇、聚乙二醇等)、表面活性剂(如吐温-80、Kolliphor EL、Solutol® HS 15等)、环糖类(β-环糊精、磺丁基-β-环糊精、羟丙基-β-环糊精)和含水稀释剂(如缓冲液、生理盐水、葡萄糖等),可以通过口服、静脉注射、皮下注射、肌肉注射和腹腔注射等多种途径给药。
表1. 单剂量PK研究中的标准赋形剂
给药途径 | 类型 | 制剂 | 制剂表征 |
口服制剂 | 混悬液 | 0.5% MC, 0.2% Tween 80 水溶液 | 显微检测:粒径 |
0.5% HPMC, 0.2% SLS 水溶液 | |||
溶液 | 10% - 20% 环糊精水溶液(pH调节) | 液相检测:溶解度 | |
10% Solutol1 HS 15 或 VE-TPGS,水溶液(pH 调节) | |||
5% 乙醇,30% PEG(200-400),水溶液(pH 调节) | |||
口服创新制剂 | 自乳剂(LogP>5) | 40% Cremophor EL, 60 %Capmul PG8 | 显微检测:粒径,粒径分布,乳滴大小 |
15 % EtOH, 50 % Solutol1 HS 15, 35% Gelucire1 44/14 | |||
固体分散体 (20%-50%药量) | 水溶性载体Co-povidone, Poloxamer188 | ||
肠溶载体HPMCAS, Eudragit | |||
纳米制剂 | PVP, HPMC, SLS稳定体系 | ||
注射制剂 | 常用注射液 | 等渗水溶液(生理盐水,5%葡萄糖,缓冲液) | 渗透压,pH,血浆沉淀/溶血测试 |
10% - 20% 环糊精水溶液(pH 3 - 8) | |||
10 % EtOH, 30% PG,缓冲液(pH 3 - 8) | |||
乳剂 | 微米乳,纳米乳 | ||
载体递送 | 纳米脂质体,微球 | ||
眼科制剂 | 滴眼液 | 1.2% HPMC / 20.5%Poloxamer / 78.3% pH 6.0磷酸缓冲液 | 显微检测:粒径 渗透压,pH |
10% HP-α-CD in pH 7.4 磷酸缓冲液 | |||
玻璃体内注射 | pH 7.4磷酸缓冲液 | ||
磷酸缓冲液, 40 mM NaCl, 5% 葡萄糖, pH 7.4, 0.02% Tween-20 |
二、药效学研究中制剂开发策略
药效学研究一般是在给定的动物模型中确定最小有效剂量,另外需要根据前期DMPK和药学CMC等数据,以确定研究中血液或其它基质收集的最佳时间点,从而获得有关动物体内暴露的可靠数据,建立PK/PD (Pharmacokinetics / Pharmacodynamic) 关系,剂量-反应关系等,以及在毒理学研究中评估供试品在关键器官或组织的毒性。
药效学研究与PK研究有所不同,为了验证药物活性和相关机制,对于不同的疾病类型和治疗领域,药效学研究中使用的制剂可能不同,需综合考虑实验设计、种属选择、剂量要求以及持续时间等因素[7]。
除制剂的溶解度、稀释沉淀效应、稳定性和耐受性外,药效学研究中制剂的开发要避免由于某些赋形剂的存在而干扰或掩盖供试品药效学性质或疗效。例如,在糖尿病和代谢性疾病适应症的动物模型中建议避免使用糖或脂质赋形剂,在疼痛动物模型中建议避免使用某些表面活性剂作为赋形剂[3]。
另外,在药效学研究中,可以通过制剂优化策略助力药物更好吸收而发挥药效,从而将某些体外理化性质不佳但有治疗潜力的化合物继续向后期研发推进。如Faranak Dehghani等人[8]以亲脂疏水的BCS II 类药物柠檬酸他莫昔芬 (Tamoxifen citrate, TMC) 为模型药,以芝麻油、吐温80和食用甘油分别作为油相、表面活性剂和助表面活性剂制备了水包油型微乳制剂用于BALB/C小鼠乳腺癌治疗的研究。将雌性BALB/C小鼠使用乳腺癌肿瘤造模后,以未载药空白微乳制剂与TMC市售片剂为对照,探索了口服TMC微乳制剂后对雌性BALB/C小鼠乳腺癌药效的影响。图5结果表明,未载药空白微乳组5周后小鼠肿瘤体积明显增大,体重一定程度降低,表明空白微乳载体几乎没有药效;TMC片剂口服后能一定程度抑制肿瘤体积增大,但小鼠体重有所降低,TMC市售片剂具备一定药效;与TMC市售片剂相比,TMC微乳制剂可显著抑制肿瘤体积增长并一定程度避免了小鼠体重的减轻,药效更佳。结果显示,通过制剂优化降低粒径、增大溶解度、可以提高药物药效。
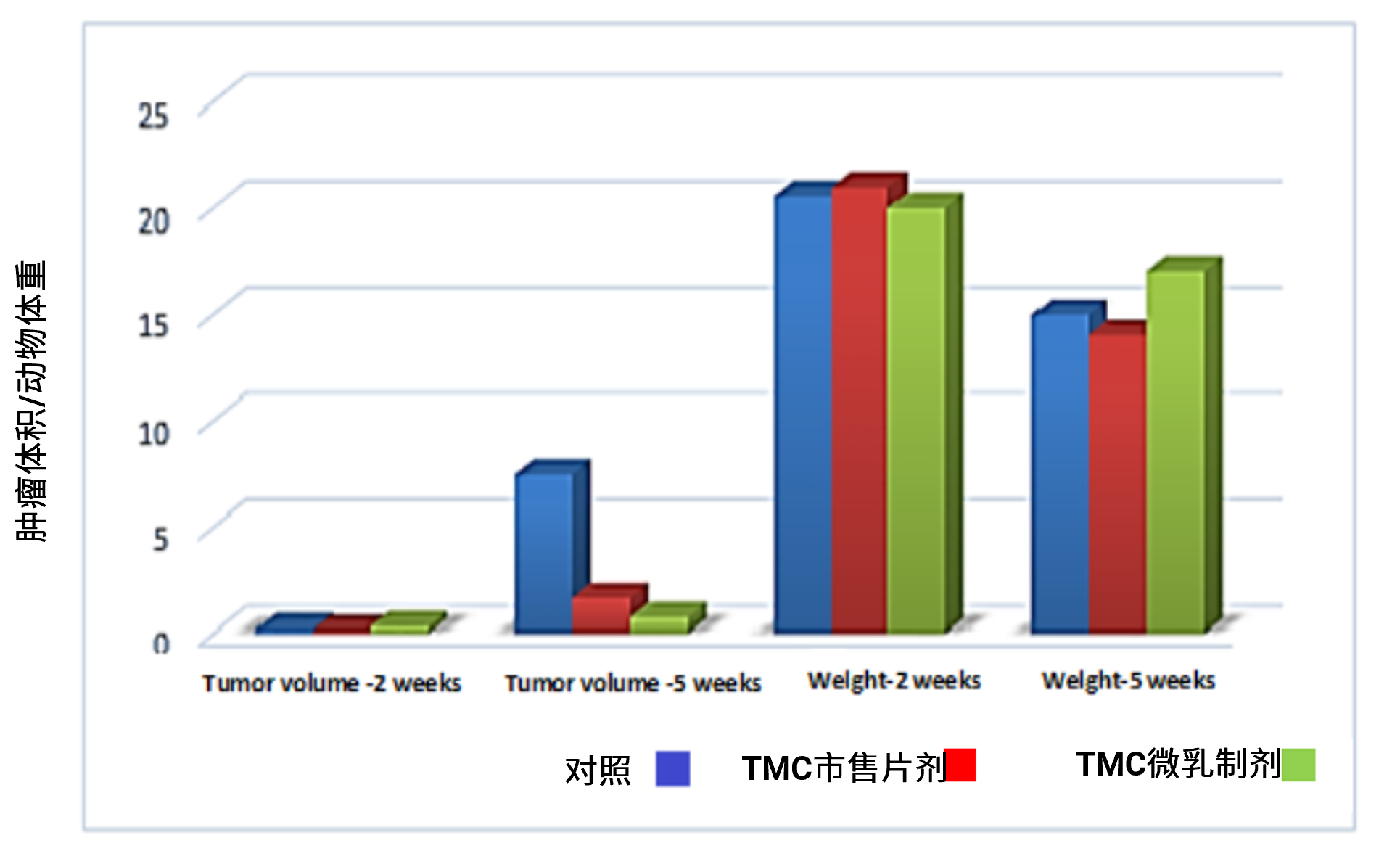
图5. 3组小鼠经不同制剂给药2周和5周后的肿瘤体积和小鼠体重
三、毒理学研究中制剂开发策略
申请IND用于临床研究之前,监管机构会要求进行啮齿动物和非啮齿动物的毒理学(TOX)研究,评估供试品的潜在安全性和未见不良反应剂量 (No Observed Adverse Effect Level, NOAEL),此阶段需要给予动物足够高的剂量,以达到较高水平的全身暴露量。TOX研究中制剂开发需要充分考虑给药体积较大,给药时间较长的特点,避免供试品本身以外的因素造成的动物异常反应。
用于急毒和长毒研究的制剂,一般简单安全的溶液或混悬液体配方是首选,但对于溶解度差、渗透性差或体循环暴露量低的化合物需要制剂措施提高体内暴露量。对于溶解度差的化合物的增溶和PK研究中制剂开发策略相似,通过选择合适溶媒,减少粒径或开发成新剂型如固体分散剂等;对于吸收差、代谢强而体循环暴露量低的化合物,可以通过将化合物开发成自乳化微乳、脂质剂型、包合物、固体分散体或纳米粒递送系统等制剂来提高体内暴露量。
下图6为默克公司公开披露数据[9],将某难溶性药物(在各类溶媒中的溶解度均小于1 mg/mL)经制剂优化后,考察其在雄性Wistar大鼠体内的暴露量。数据表明,相对于使用表面活性剂或共溶剂增溶开发为溶液剂,将制剂进行自乳化或者开发成纳米粒递送系统后,可以显著地提高低剂量10 mg/kg和高剂量100 mg/kg体内暴露量水平;尤其是将药物开发成纳米粒递送系统后,高剂量100 mg/kg下体内暴露水平显著提高,有效满足毒理实验需较高全身暴露量的实验需求。

图6. 某难溶性药物不同制剂在雄性Wistar大鼠体内的暴露量
在实际应用中,需依据化合物性质、种属选择及具体实验设计开发适合制剂用于毒理学研究。
结语
药明康德药物代谢与动力学部DMPK依托部门完善平台,建立了一套通用溶媒配方筛选与药代动力学评估体系,团队依据大量项目经验形成了临床前动物实验的组合溶媒数据库,可在1个工作日内依据实验设计与化合物性质筛选出动物可耐受的合适溶媒用于临床前药代动力学研究,也可在3-5个工作日内筛选出10多个不同组合的可用于初步毒性研究的实验溶媒。
药物康德合全药业制剂业务部具备药物固态化学研究、物理化学表征和各类制剂开发技术,如常规片剂胶囊、缓控释包衣、喷雾干燥固体分散体、热熔挤出技术、纳米混悬液、液体填充胶囊、儿童制剂和高活性无菌注射剂等,可提供多种剂型开发和制造服务。合全药业创新药临床申报处方前研究一体化平台(IEPP)能针对新化学实体(NCE)提供一站式“端到端”的化合物成药性评估。IEPP平台可以帮助创新药合作伙伴尽早识别新药开发进程中的挑战和风险,并及时寻求适合的解决方案,以更优化的成本,推进新药上市的进程。
在溶媒,制剂制备与优化过程中,药明康德药物代谢与动力学部DMPK与合全STA制剂业务部紧密合作,整合技术与平台规模,通过跨部门的资源共享实现时间与成本的优化,助力从溶媒,制剂筛选到药品临床申报的全流程,加快推进药物研发及申报速度。
药明康德DMPK依托在中国(上海、苏州、南京和南通)和美国(新泽西)的研发中心,提供从早期筛选、临床前开发、到临床研究阶段的综合型药代动力学服务,助力您快速推进药物研发流程。拥有上千人的研发团队,服务超1500家全球客户,具有超过十五年的新药申报经验,已成功支持超过1200个新药临床研究申请(IND)。
点击此处可与我们的专家进行联系。
作者:张娟娟1,田彬彬1,杨光1,金晶1,赵甜静2,毛亮2
编辑:方健,钱卉娟
设计:倪德伟,张莹莹
1药明康德测试事业部药物代谢与动力学部团队;2合全药业制剂业务部可开发性和制剂研究团队
参考
[1] Chen X Q , Antman M D , Gesenberg C ,et al. Discovery Pharmaceutics—Challenges and Opportunities[J].The AAPS Journal, 2006, 8(2):E402-8.DOI:10.1208/aapsj080246.
[2] 爱德华·H.克恩斯,邸力.类药性质:概念、结构设计与方法从ADME到安全性优化[M].科学出版社,2011.
[3] Discovering and Developing Molecules with Optimal Drug-Like Properties, Chapter 1 Formulation Approaches for Preclinical Studies, P22-P31
[4] Wu Y , Loper A , Landis E ,et al.The role of biopharmaceutics in the development of a clinical nanoparticle formulation of MK-0869: a Beagle dog model predicts improved bioavailability and diminished food effect on absorption in human[J].Int J Pharm, 2004, 285(1-2):135-146.DOI:10.1016/j.ijpharm.2004.08.001.
[5] Maas J , Kamm W , Hauck G .An integrated early formulation strategy--from hit evaluation to preclinical candidate profiling.[J].European Journal of Pharmaceutics & Biopharmaceutics, 2007, 66(1):1-10.DOI:10.1016/j.ejpb.2006.09.011.
[6] J. Cunningham, E. Merisko-Liversidge, E.R. Cooper, G.G. Liversidge, Milling microgram quantities of nanoparticulate candidate compounds, PCT/US2003/039941.
[7] Discovering and Developing Molecules with Optimal Drug-Like Properties, Chapter 2 Discovery Formulations: Approaches and Practices in Early Preclinical Development, P65-72
[8] A F D , A N F , B S G ,et al. Preparation, characterization and in-vivo evaluation of microemulsions containing tamoxifen citrate anti-cancer drug[J].European Journal of Pharmaceutical Sciences, 2017, 96:479-489.DOI:10.1016/j.ejps.2016.09.033.
[9] Higgins J , Cartwright M E , Templeton A C .Progressing preclinical drug candidates: strategies on preclinical safety studies and the quest for adequate exposure.[J].Drug Discovery Today, 2012, 17(15-16):828-836.DOI:10.1016/j.drudis.2012.03.016.
加入订阅
获取药物代谢与药代动力学最新专业内容和信息













